(2023) Đề thi thử Hóa Học THPT soạn theo ma trận đề minh họa BGD ( Đề 1) có đáp án
(2023) Đề thi thử Hóa Học THPT soạn theo ma trận đề minh họa BGD ( Đề 1) có đáp án
-
587 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 6:
Cho dung dịch NaOH dư vào dung dịch chất X, thu được kết tủa màu nâu đỏ. X là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 8:
Phản ứng của ancol và axit cacboxylic (xúc tác H2SO4 đặc) tạo thành este có tên gọi là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 11:
Tính chất nào sau đây không phải là tính chất vật lý chung của kim loại?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 13:
Trong khí thải công nghiệp thường chứa các khí: SO2, NO2, HF. Có thể dùng chất nào (thông dụng) sau đây để loại các khí đó?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 15:
Điện phân dung dịch NaCl (có màng ngăn xốp), ở catot thu được chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 17:
Phản ứng nào sau đây có phương trình ion rút gọn là H+ + OH- → H2O?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 18:
Nguyên tố kim loại nào sau đây có số oxi hóa cao nhất là +6 trong hợp chất?
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 19:
Cho thanh Zn vào 10 ml dung dịch CuSO4 nồng độ aM. Khi CuSO4 phản ứng hết thấy khối lượng dung dịch thu được tăng 0,01 gam so với dung dịch ban đầu. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 20:
X là loại đường phổ biến nhất, có trong nhiều loài thực vật, nhiều nhất trong cây mía, củ cải đường và hoa thốt nốt. Tên gọi của X là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 21:
Từ CO2 và H2O, dưới tác dụng của diệp lục, phản ứng quang hợp tạo thành chất X. Thuỷ phân hoàn toàn chất X trong môi trường axit tạo thành chất Y. Chất Y lên men tạo thành chất Z và cacbon đioxit. Các chất X và Z lần lượt là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 24:
Đốt cháy hoàn toàn cacbohiđrat X, cần vừa đủ 5,6 lít O2 (đktc). Sản phẩm cháy thu được hấp thụ hoàn toàn vào 150 ml dung dịch Ba(OH)2 1M, thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn B.
Khi đốt cacbohiđrat thu được mol O2 và CO2 bằng nhau và bằng 0,25 mol
Dẫn khí CO2 vào dung dịch Ba(OH)2 (0,15 mol) có tỉ lệ nOH-/nCO2 = 1,2 ® tạo 2 muối
Trong đó: n¯ = 0,3 – 0,25 = 0,05 mol Þ m¯ = 9,85g.
Câu 25:
Đốt cháy hoàn toàn 6,2 gam metylamin, thu được H2O và V lít hỗn hợp khí gồm CO2 và N2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 26:
Phân tích một mẫu nước cứng thấy có chứa các ion: Ca2+, Mg2+, Cl-, HCO3-; trong đó nồng độ Cl- là 0,006M và của HCO3- là 0,01M. Cần lấy bao nhiêu ml dung dịch Na2CO3 0,2M để chuyển 1 lít nước cứng trên thành nước mềm? (Coi nước mềm là nước không chứa các ion Ca2+, Mg2+)
 Xem đáp án
Xem đáp án
Chọn A.
Bảo toàn điện tích: = (0,006 + 0,01)/2 = 0,008 mol
Ca2+, Mg2+ + CO32- ® MgCO3, CaCO3
Þ = 0,008 Þ Vdd = 40 ml.
Câu 27:
Muối X đốt cháy trên ngọn lửa đèn cồn cho ngọn lửa màu vàng tươi. Cho X tác dụng với dung dịch Ba(OH)2 tạo thành kết tủa Y. Biết Y bị tan hết trong dung dịch HCl dư. Muối X là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 28:
Thực hiện phản ứng este hóa giữa axit acrylic với ancol đơn chức X, thu được este Y. Biết rằng trong Y, oxi chiếm 25% về khối lượng. Công thức của ancol X là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 29:
Khí T được thu được phương pháp đẩy nước theo hình vẽ sau:
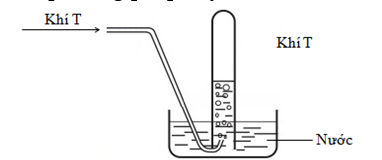
Cho dãy các khí: N2, NH3, HCl, C2H4. Số khí trong dãy phù hợp với phương pháp thu trên?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 30:
Hỗn hợp X gồm 0,01 mol H2NC2H4COOH và a mol Y có dạng (H2N)2CnH2n-1COOH. Cho X vào dung dịch chứa 0,06 mol HCl, thu được dung dịch Z. Toàn bộ dung dịch Z phản ứng vừa đủ với dung dịch chứa 0,03 mol NaOH và 0,06 mol KOH, thu được dung dịch chứa 8,94 gam muối. Phân tử khối của Y và giá trị của a lần lượt là
 Xem đáp án
Xem đáp án
Chọn A.
Muối gồm H2NC2H4COO- (0,01), (H2N)2RCOO- (a), Cl- (0,06), Na+ (0,03), K+ (0,06)
Bảo toàn điện tích: 0,03 + 0,06 = 0,01 + a + 0,06 Þ a = 0,02
mmuối = 0,01.88 + 0,02(R + 76) + 0,06.35,5 + 0,03.23 + 0,06.39 = 8,94 Þ R = 69
Þ MY = 69 + 77 = 146
Câu 31:
Cho các phát biểu sau:
(a) Glucozơ được ứng dụng trong y học dùng để pha huyết thanh.
(b) Dầu vừng và dầu oliu đều có thành phần chính là chất béo.
(c) Cao su sau khi được lưu hóa có tính đàn hồi và chịu nhiệt tốt hơn.
(d) Khi làm trứng muối (ngâm trứng trong dung dịch NaCl bão hòa) xảy ra hiện tượng đông tụ protein.
(e) Để giảm độ chua của món sấu ngâm đường, có thể thêm một ít vôi vào.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn A.
Tất cả các ý đều đúng.
Câu 32:
Cho các phát biểu sau:
(a) Sục khí CO2 tới dư vào dung dịch KAlO2, thu được kết tủa trắng.
(b) Nhỏ dung dịch Ba(HCO3)2 vào dung dịch KOH, thu được kết tủa trắng và có khí thoát ra.
(c) Phèn chua có công thức thu gọn là NaAl(SO4)2.12H2O.
(d) Các thiết bị máy móc bằng kim loại tiếp xúc với hơi nước ở nhiệt độ cao có khả năng bị ăn mòn hoá học.
(e) Bột Al trộn với bột Fe2O3 (gọi là hỗn hợp tecmit) dùng hàn đường ray xe lửa.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
(b) Sai, nhỏ dung dịch Ba(HCO3)2 vào dung dịch KOH, thu được kết tủa trắng BaCO3.
(c) Sai, phèn chua có công thức thu gọn là KAl(SO4)2.12H2O.
Câu 33:
Xăng E5 là một loại xăng sinh học, được tạo thành khi trộn 5 thể tích C2H5OH (D = 0,8 g/ml) với 95 thể tích xăng truyền thống, giúp thay thế một phần nhiên liệu hóa thạch đang ngày càng cạn kiệt cũng như giảm thiểu ô nhiễm môi trường. Khi đốt cháy hoàn toàn 1 lít xăng E5 thì hạn chế được x phần trăm thể tích khí CO2 thải vào không khí so với đốt cháy hoàn toàn 1 lít xăng truyền thống ở cùng điều kiện nhiệt độ và áp suất. Giả sử xăng truyền thống chỉ chứa hai ankan C8H18 và C9H20 (tỉ lệ mol tương ứng 4 : 3 và D = 0,7 g/ml). Giá trị của a gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn C.
• Đốt 1 lít E5:
= 1000.5%.0,8/46 = 0,8696 mol
= 4x mol; = 3x mol
Ta có: 114.4x + 128.3x = 1000.95%.0,7 Þ x = 0,7917
= 0,8696.2 + 8.4x + 9.3x = 48,4495
• Đốt 1 lít xăng truyền thống: = (8.4x + 9.3x).1000/950 = 49,1687
Þ x = (49,1687 – 48,4495)/49,1687 = 1,46%
Câu 34:
Đốt cháy hoàn toàn 0,12 mol hỗn hợp P gồm axit linoleic (C17H31COOH), tripanmitin, trieste X cần dùng 7,03 mol O2 thu được hỗn hợp gồm 4,98 mol CO2 và 4,74 mol H2O. Mặt khác, m gam P tác dụng vừa đủ với dung dịch NaOH thu được hỗn hợp Y gồm ba muối C17H31COONa, C15H31COONa, RCOONa có tỉ lệ mol tương ứng là 1 : 13 : 2. Biết số mol trieste X lớn hơn số mol axit linoleic, phần trăm khối lượng của X trong P gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn B.
P gồm axit linoleic (a mol), tripanmitin, trieste X (tổng b mol) Þ nP = a + b = 0,12
Bảo toàn O: 2a + 6b + 7,03.2 = 4,98.2 + 4,74
Þ a = 0,02; b = 0,1
Þ nmuối = a + 3b = 0,32
Y gồm C17H31COONa (0,02), C15H31COONa (0,26), RCOONa (0,04)
Vì nX > 0,02 Þ nX = nRCOONa = 0,04 mol
P gồm C17H31COOH (0,02), (RCOO)(C15H31COO)2A (0,04) và (C15H31COO)3C3H5 (0,06)
Bảo toàn khối lượng Þ mP = 79,48g
Þ %mX = 32,11%.
Câu 35:
Một loại phân bón NPK có tỉ lệ dinh dưỡng ghi trên bao bì là 20 – 20 – 15. Mỗi hecta đất trồng ngô, người nông dân cần cung cấp 150kg N, 60kg P2O5 và 110kg K2O. Người nông dân sử dụng đồng thời phân bón NPK (20-20-15), phân kali (độ dinh dưỡng 60%) và ure (độ dinh dưỡng 46%). Biết giá thành mỗi kg phân NPK, phân kali, phân ure lần lượt là 14,000 VNĐ, 18,000 VNĐ và 20,000 VNĐ. Tổng số tiền (VNĐ) mà người nông dân cần mua phân cho một hecta ngô là
 Xem đáp án
Xem đáp án
Chọn A.
m phân NPK = a kg, m phân kali = b kg, m phân urê = c kg
mN = 20%a + 46%c = 150
= 20%a = 60
= 15%a + 60%b = 110
Þ a = 300; b = 325/3; c = 4500/23
Số tiền = 14000a + 18000b + 20000c = 10063043 VNĐ.
Câu 36:
Đun nóng m gam hỗn hợp E gồm Al, Fe3O4 và MO có tỉ lệ tương ứng 5 : 1 : 2 (biết nguyên tố oxi chiếm 18,1474% khối lượng trong E) trong khí trơ thu được hỗn hợp rắn F. Chia F thành hai phần. Phần một phản ứng tối đa với dung dịch NaOH (dư) thu được 1,96 lít khí H2. Phần hai tan hết trong dung dịch chứa 2,25 mol HNO3 loãng thu được dung dịch T chứa các muối trung hòa và 3,36 lít khí NO. Dung dịch T làm mất màu vừa hết 300 ml dung dịch KMnO4 0,1M trong lượng dư H2SO4 loãng. Các phản ứng xảy ra hoàn toàn và thể tích các khí đo ở đktc. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn C.
%O = Þ M = 65 (Zn)
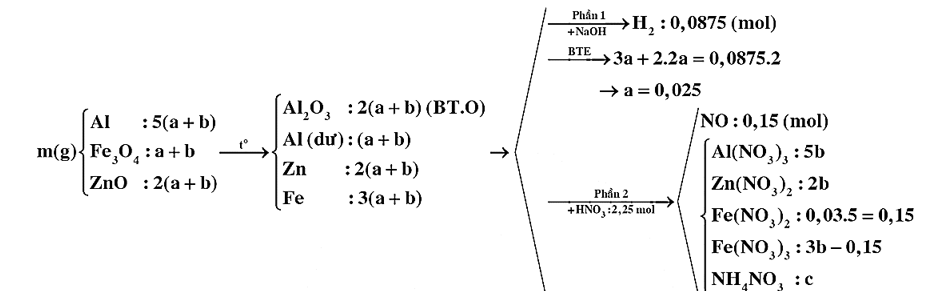
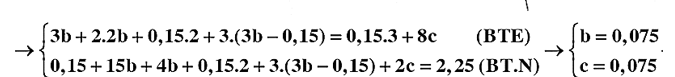
BTKL: m = 52,9g
Câu 37:
X, Y là hai chất hữu cơ kế tiếp thuộc dãy đồng đẳng ancol anlylic (CH2=CHCH2OH), Z là axit cacboxylic no hai chức, T là este tạo bởi X, Y, Z. Đốt cháy 17,12 gam hỗn hợp E chứa X, Y, Z, T (đều mạch hở) cần dùng 10,864 lít O2 (đktc) thu được 7,56 gam nước. Mặt khác 17,12 gam E làm mất màu vừa đủ dung dịch chứa 0,09 mol Br2. Nếu đun nóng 0,3 mol E với 450 ml dung dịch KOH 1M, cô cạn dung dịch sau phản ứng rồi sau đó lấy phần lỏng chứa các chất hữu cơ đi qua bình đựng Na dư thấy khối lượng bình tăng m gam. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn C.
Quy đổi hỗn hợp E thành: CnH2nO (0,09 mol – tính từ mol Br2), CmH2m-2O4: a mol và H2O: -b mol
mE = 0,09(14n + 16) + a(14m + 62) – 18b = 17,12
= 0,09(1,5n – 0,5) + a(1,5m – 2,5) = 0,485
= 0,09n + a(m – 1) – b = 0,42
Giải hệ trên được: 0,09n + am = 0,57, a = 0,13, b = 0,02
Þ 0,09n + 0,13m = 0,57
Þ 9n + 13m = 57
Do n > 3 và m ≥ 2 Þ n = 31/9 và m = 2 là nghiệm duy nhất.
Do = -0,02 Þ nT = 0,01 mol Þ nZ = a – nT = 0,12 mol
Có 0,01 mol mỗi ancol nằm trong T nên trong E còn 0,07 mol ancol Þ nE = 0,2 mol
Nếu đun 0,3 mol E với KOH (gấp 1,5 lần so với 0,2 mol) 0,45 mol thì KOH dư
Þ Phần chất lỏng thu được sau khi cô cạn là ancol CnH2nO (0,09.1,5 = 0,135 mol)
mbình Na tăng = mancol – = 0,135.(14n + 16) – 2.0,135/2 = 8,535g
Câu 38:
Cho sơ đồ các phản ứng sau:
(1) FeCl3 + NH3 + H2O → X + NH4Cl
(2) X + Y → FeCl3 + H2O
(3) NaHCO3 + Y → Z + H2O + CO2
Các chất X, Z thỏa mãn sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
Chọn B.
Câu 39:
Hòa tan hoàn toàn hỗn hợp gồm a mol Fe(NO3)3, b mol Cu(NO3)2, c mol NaCl vào nước được dung dịch X. Điện phân X với cường độ dòng điện không đổi là 5A, hiệu suất điện phân là 100%. Kết quả thí nghiệm được ghi trong bảng sau:
|
Thời gian điện phân (giây) |
t |
2t |
2t + 579 |
|
Tổng số mol khí ở 2 điện cực (mol) |
0,02 |
0,0375 |
0,05 |
|
Khối lượng catot tăng (gam) |
0,64 |
x |
2,4 |
|
Dung dịch sau điện phân |
Y |
Z |
T |
Cho dung dịch AgNO3 dư vào dung dịch Y thu được m gam kết tủa. Giá trị của m và x lần lượt là
 Xem đáp án
Xem đáp án
Chọn A.
Lúc t giây:
Catot: = a mol; nCu = 0,01mol
Anot: = 0,02 mol
Bảo toàn e: a + 0,01.2 = 0,02.2 Þ a = 0,02 Þ ne trong t giây = 0,04 mol
Lúc 2t giây: ne = 0,08 mol
Nếu anot chỉ có Cl2: = 0,04 > 0,0375: Vô lý, vậy anot đã có O2.
Trong 579s (tính từ 2t đến 2t + 579) có ne = 0,03 mol
(trong 579s này) = 0,03/4 = 0,0075 mol
Þ (trong 579s này) = 0,05 – 0,0075 – 0,0375 = 0,005 mol
® nR (trong 579s này) = (0,03 – 0,005.2)/2 = 0,01
R là Cu, Fe, hai kim loại này đã thoát ra hết (tổng 2,4 gam), trong đó nFe = a = 0,02 mol Þ nCu = 0,02 mol
Vậy lúc 2t giây (0,08 mol electron), tại catot thoát ra Fe2+ (0,02), Cu (0,02) Þ nFe = 0,01
x = 0,02.64 + 0,01.56 = 1,84
Anot lúc 2t giây: = 0,035 mol và = 0,0025 mol (Bấm hệ n khí tổng = 0,0375 và ne = 0,08)
mol và
Þ m↓ = 6,465 gam
Câu 40:
Chất hữu cơ E mạch hở có công thức phân tử C8H8O5 thỏa mãn sơ đồ phản ứng sau:
E+ NaOH X + Y + Z
Z + CuO T + Cu + H2O
G + O2 Y
Biết các kí hiệu X, Y, Z, T, G đều là các chất hữu cơ thuần chức; Y và T có cùng số nguyên tử cacbon. Cho các phát biểu sau:
(a) Trong phản ứng với Br2 trong dung dịch, chất Y đóng vai trò là chất khử.
(b) Chất Z được dùng để pha chế chất sát khuẩn.
(c) Đốt cháy hoàn toàn 1 mol Y, thu được 5 mol sản phẩm gồm Na2CO3, CO2 và H2O.
(d) Chất X có đồng phân cis-trans.
(e) 1 mol chất T tác dụng với lượng dư AgNO3 trong NH3 tạo ra tối đa 4 mol Ag.
(g) Chất G có khả năng kích thích quá trình chín của trái cây.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn D.
E là HO-CH2-CH2-OOC-C≡C-COO-CH=CH2
X là NaOOC-C≡C-COONa
Y là CH3CHO Þ G là C2H4
Z là C2H4(OH)2 Þ T là (CHO)2
(a) Đúng, anđehit đóng vai trò là chất khi tác dụng với các chất oxi hóa như Br2, O2, KMnO4.
(b) Sai, C2H5OH dùng để pha chế chất sát khuẩn.
(c) Sai, Đốt 1 mol Y ® 1 mol Na2CO3 + 3 mol CO2.
(d) Sai. X không có đồng phân hình học.
(e) Đúng.
(g) Đúng.
