(2023) Đề thi thử Hóa Liên THPT cụm 7 trường THPT, Hải Dương (Lần 3) có đáp án
(2023) Đề thi thử Hóa Liên THPT cụm 7 trường THPT, Hải Dương (Lần 3) có đáp án
-
1074 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 2:
Trong những năm 30 của thế kỉ XX, các nhà hóa học của hãng Du Pont (Mỹ) đã thông báo phát minh ra một loại vật liệu ‘‘mỏng hơn tơ nhện, bền hơn thép và đẹp hơn lụa’’. Theo thời gian, vật liệu này đã có mặt trong cuộc sống hàng ngày của con người, phổ biến trong các sản phẩm như lốp xe, dù, quần áo, tất, … Một trong số vật liệu đó là tơ nilon–6. Công thức của tơ nilon–6 là
 Xem đáp án
Xem đáp án
Chọn D
Câu 4:
Cây bông là cây trồng lấy sợi quan trọng ở các nước nhiệt đới. Từ xa xưa, dân gian ta có câu:
"Trên trời mây trắng như bông
Ở dưới cánh đồng bông trắng như mây".
Sợi bông là nguyên liệu chủ yếu trong công nghiệp dệt với các đặc tính tự nhiên như cách nhiệt, mềm mại, co giãn, thoáng khí. Thành phần chủ yếu của sợi bông là
 Xem đáp án
Xem đáp án
Chọn B
Câu 6:
Trong quá trình điện phân Al2O3 nóng chảy, người ta thêm một ít criolit (Na3AlF6) vào nhằm mục đích chính là
 Xem đáp án
Xem đáp án
Trong quá trình điện phân Al2O3 nóng chảy, người ta thêm một ít criolit (Na3AlF6) vào nhằm mục đích chính là giảm nhiệt độ nóng chảy của Al2O3.
Câu 7:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
C sai, (C17H31COO)3C3H5 là chất béo không no nên tồn tại ở trạng thái lỏng trong điều kiện thường.
Câu 8:
Điều nào sau đây không đúng khi nói về metyl metacrylat?
 Xem đáp án
Xem đáp án
A không đúng, metyl metacrylat (CH2=C(CH3)COOCH3) có tác dụng với dung dịch nước brom.
Câu 10:
Canxi oxit có tính hút ẩm mạnh nên dùng để làm khô nhiều chất. Công thức của canxi oxit là
 Xem đáp án
Xem đáp án
Chọn B
Câu 11:
Gần đây, rất nhiều trường hợp tử vong do uống phải rượu giả được pha chế từ cồn công nghiệp. Một trong những hợp chất độc hại trong cồn công nghiệp chính là metanol (CH3OH). Tên gọi khác của metanol là
 Xem đáp án
Xem đáp án
Chọn B
Câu 12:
Một loại nước cứng khi được đun sôi thì mất tính cứng. Trong loại nước cứng này có hoà tan những hợp chất nào sau đây?
 Xem đáp án
Xem đáp án
Nước cứng tạm thời khi được đun sôi thì mất tính cứng. Nước cứng tạm thời chứa Ca(HCO3)2, Mg(HCO3)2:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Mg(HCO3)2 → MgCO3 + CO2 + H2O
Câu 13:
Trong phòng thí nghiệm, kim loại Na được bảo quản bằng cách ngâm trong chất lỏng nào sau đây?
 Xem đáp án
Xem đáp án
Để bảo quản kim loại Na trong phòng thí nghiệm người ta ngâm trong dầu hỏa vì dầu hỏa không tác dụng với Na và tạo một lớp ngăn cách giữa Na và môi trường xung quanh.
Câu 14:
Vào mùa lũ, để có nước sử dụng, dân cư ở một số vùng thường sử dụng chất X (Có công thức K2SO4.Al2(SO4)3.24H2O) để làm trong nước. Chất X được gọi là
 Xem đáp án
Xem đáp án
Chọn B
Câu 15:
Kim loại nhôm bị oxi hoá trong dung dịch kiềm (dung dịch NaOH). Trong quá trình đó chất oxi hoá là
 Xem đáp án
Xem đáp án
Chọn A
Câu 16:
Thạch cao nung thu được khi đun nóng thạch cao sống ở 160°C, được dùng để nặn tượng, bó bột. Công thức của thạch cao nung là
 Xem đáp án
Xem đáp án
Chọn C
Câu 17:
Fe bị ăn mòn điện hoá học khi tiếp xúc với kim loại M, để ngoài không khí ẩm. Vậy M là
 Xem đáp án
Xem đáp án
Chọn B
Câu 18:
Ở nhiệt độ thường, trong không khí ẩm, sắt bị oxi hóa tạo thành gỉ sắt màu nâu đỏ do có phản ứng
 Xem đáp án
Xem đáp án
Chọn B
Câu 19:
Tiến hành thí nghiệm phản ứng của hồ tinh bột với iot theo các bước sau đây:
- Bước 1: Cho vài giọt dung dịch iot vào ống nghiệm đựng sẵn 1 - 2 ml dung dịch hồ tinh bột (hoặc nhỏ vài giọt dung dịch iot lên mặt cắt quả chuối xanh hoặc củ khoai lang tươi, sắn tươi).
- Bước 2: Đun nóng dung dịch một lát, sau đó để nguội.
Cho các nhận định sau:
(a) Ở bước 1, xảy ra phản ứng của iot với tinh bột, dung dịch trong ống nghiệm chuyển sang màu xanh tím.
(b) Ở bước 1, thay dung dịch hồ tinh bột bằng mặt cắt quả chuối chín thì màu xanh tím cũng xuất hiện.
(c) Ở bước 2, màu của dung dịch có sự biến đổi: xanh tím → không màu → xanh tím
(d) Do cấu tạo ở dạng xoắn có lỗ rỗng, tinh bột hấp phụ iot cho màu xanh tím.
(e) Ở thí nghiệm trên, nếu thay hồ tinh bột bằng glucozơ thì sẽ thu được kết quả tương tự.
Số nhận định đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Sai, chuối chín hầu như không còn tinh bột nên không có hiện tượng gì
(c) Đúng
(d) Đúng
(e) Sai, glucozơ không có phản ứng màu với I2.
Câu 20:
Trong phân tử aminoaxit X có một nhóm amino và một nhóm caboxyl. Cho 15,0 gam X tác dụng vừa đủ với dung dịch NaOH, cô cạn dung dịch sau phản ứng thu được 19,4 gam muối khan. Công thức của X là
 Xem đáp án
Xem đáp án
nX = (19,4 – 15)/22 = 0,2
→ MX = 15/0,2 = 75: H2NCH2COOH
Câu 23:
Chất nào sau đây thuộc loại amin bậc một?
 Xem đáp án
Xem đáp án
Amin bậc 1 do 1H trong NH3 bị thay thế bởi 1 gốc hiđrocacbon → CH3NH2 là amin bậc 1.
Câu 25:
Số đipeptit tối đa có thể tạo ra từ một hỗn hợp gồm alanin và glyxin là
 Xem đáp án
Xem đáp án
Có tối đa 4 đipeptit: Gly-Gly, Ala-Ala, Gly-Ala và Ala-Gly
Câu 26:
Trong sơ đồ thực nghiệm theo hình vẽ sau đây:
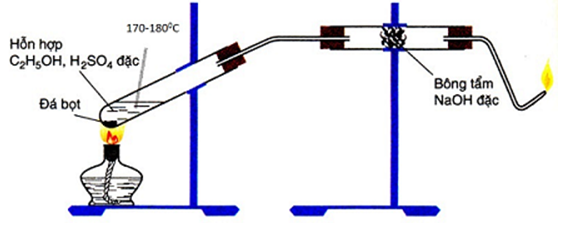
Chọn phát biểu đúng.
 Xem đáp án
Xem đáp án
Hình vẽ là sơ đồ điều chế và thử tính chất của C2H4.
A. Đúng
C2H4 + H2O + KMnO4 → C2H4(OH)2 + KOH + MnO2
B. Sai. Phản ứng có sản phẩm phụ là SO2, nó được tạo ra do H2SO4 bị khử. Bông tẩm NaOH có tác dụng ngăn SO2 thoát ra cùng sản phẩm chính C2H4.
C. Sai, tại mức nhiệt độ trên 170°C thì phản ứng chính là: C2H5OH → C2H4 + H2O
D. Sai. H2SO4 có vai trò xúc tác cho phản ứng.
Câu 27:
Xà phòng hoá 8,8 gam etyl axetat bằng 200 ml dung dịch NaOH 0,2M. Sau phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được chất rắn khan có khối lượng là
 Xem đáp án
Xem đáp án
nCH3COOC2H5 = 0,1
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
0,1………………….0,04
0,04………………..0,04……….0,04
0,06…………………….0
Chất rắn chỉ có CH3COONa (0,04)
→ m rắn = 3,28 gam
Câu 28:
Nước mía chiếm 70% khối lượng của cây mía. Lượng saccarozơ trong nước mía ép là khoảng 20%. Khối lượng saccarozơ thu được từ 1,0 tấn mía nguyên liệu (cho biết hiệu suất của toàn bộ quá trình là 80%) là
 Xem đáp án
Xem đáp án
mSaccarozơ = 1000.70%.20%.80% = 112 kg
Câu 30:
Cho thứ tự bốn cặp oxi-hóa khử trong dãy điện hóa như sau: Na+/Na. Mg2+/Mg, Al3+/Al, Ag+/Ag. Cho biết trong bốn kim loại Na, Mg, Al, Ag thì kim loại có tính khử yếu nhất là
 Xem đáp án
Xem đáp án
Theo chiều từ trái sang phải, tính khử của dạng khử giảm dần → Ag có tính khử yếu nhất.
Câu 31:
Cho các phát biểu sau về cacbohiđrat:
(a) Glucozơ và saccarozơ đều là chất rắn có vị ngọt, dễ tan trong nước.
(b) Tinh bột và xenlulozơ đều là polisaccarit.
(c) Trong dung dịch, glucozơ và saccarozơ đều hoà tan Cu(OH)2, tạo phức màu xanh lam.
(d) Khi thuỷ phân hoàn toàn hỗn hợp gồm tinh bột và saccarozơ trong môi trường axit, chỉ thu được một loại monosaccarit duy nhất.
(e) Khi đun nóng glucozơ (hoặc fructozơ) với dung dịch AgNO3 trong NH3 thu được Ag.
(f) Glucozơ và saccarozơ đều tác dụng với H2 (xúc tác Ni, đun nóng) tạo sobitol.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Đúng
(c) Đúng
(d) Sai, thu được 2 loại là glucozơ và fructozơ.
(e) Đúng, cả 2 đều có phản ứng tráng gương
(g) Sai, saccarozơ không phản ứng.Câu 32:
Hòa tan hoàn toàn m gam hỗn hợp X gồm FeO, Fe3O4, FeS, FeS2, CuS và S trong dung dịch chứa 0,25 mol H2SO4 đặc, nóng (vừa đủ). Sau phản ứng thu được dung dịch Y và có 4,48 lít khí (đktc) SO2 thoát ra. Cho dung dịch Ba(OH)2 dư vào dung dịch thu được 30,7 gam kết tủa. Mặt khác, hòa tan hết m gam X bằng dung dịch HNO3 đặc, nóng thấy thoát ra hỗn hợp chứa a mol NO2 và 0,02 mol SO2. Dung dịch sau phản ứng chứa 15,56 gam hỗn hợp muối. Giá trị của a là
 Xem đáp án
Xem đáp án
Quy đổi X thành Fe (a), Cu (b), S (c) và O (d)
Bảo toàn electron: 3a + 2b + 4c = 2(0,2 – c) + 2d (1)
Dung dịch muối thu được chứa Fe3+ (a), Cu2+ (b) → SO42- (1,5a + b)
Bảo toàn S: c + 0,25 = 0,2 + 1,5a + b (2)
Với Ba(OH)2 dư, kết tủa gồm Fe(OH)3, Cu(OH)2 và BaSO4
→ 107a + 98b + 233(1,5a + b) = 30,7 (3)
Với HNO3, dung dịch muối chứa Fe3+ (a), Cu2+ (b), SO42- (c – 0,02) → NO3- (3a + 2b – 2c + 0,04)
→ 56a + 64b + 96(c – 0,02) + 62(3a + 2b – 2c + 0,04) = 15,56 (4)
(1)(2)(3)(4) → a = 0,06; b = 0,01; c = 0,05; d = 0,05
Bảo toàn electron:
0,06.3 + 0,01.2 + 0,02.4 + 6(0,05 – 0,02) = nNO2 + 0,05.2
→ nNO2 = 0,36
Câu 33:
Cho dãy các dung dịch sau: glucozơ, saccarozơ, Ala-Gly, anbumin. Số dung dịch trong dãy hòa tan được Cu(OH)2 ở điều kiện thường là
 Xem đáp án
Xem đáp án
Các dung dịch trong dãy hòa tan được Cu(OH)2 ở điều kiện thường là: glucozơ, saccarozơ, anbumin, trong đó glucozơ, saccarozơ hòa tan Cu(OH)2 do phân tử của chúng có nhiều OH liền kề (tính chất của poliancol); anbumin hòa tan Cu(OH)2 do có phản ứng màu biure.
Câu 34:
Cho các phát biểu sau:
(a) Oxi hóa glucozơ bằng H2 (xúc tác Ni, t°) thu được sobitol.
(b) Trimetylamin là amin bậc ba.
(c) Có thể dùng phản ứng màu biure để phân biệt Ala-Ala và Ala-Ala-Ala.
(d) Phenol (C6H5OH) tan rất tốt trong nước lạnh.
(e) Chất béo lỏng khó bị oxi hóa bởi oxi không khí hơn chất béo rắn.
(f) Cao su là loại vật liệu polime có tính đàn hồi.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, khử glucozơ bằng H2 (xúc tác Ni, t°) thu được sobitol.
(b) Đúng, thay thế 3H trong NH3 bằng 3 gốc hiđrocacbon → amin bậc 3.
(c) Đúng, (Ala)2 không tạo màu tím, (Ala)3 có tạo màu tím.
(d) Đúng: C6H5OH + NaOH → C6H5ONa (tan) + H2O
(e) Sai, chất béo lỏng chứa C=C ở gốc axit nên dễ bị oxi hóa bởi O2 không khí hơn chất béo rắn.
(f) Đúng.
Câu 35:
X là muối ngậm nước của kim loại M. Nung nóng m gam X đến khối lượng không đổi được 4,0 gam chất rắn Y và 10,8 gam hỗn hợp khí và hơi Z. Hấp thụ hoàn toàn Z vào 50 gam dung dịch NaOH 8,0% được dung dịch T chỉ chứa một chất tan có nồng độ 13,98%. Biết rằng quá trình nhiệt phân không làm thay đổi số oxi hoá của M. Phần trăm khối lượng của nguyên tố oxi trong X gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nNaOH = 50.8%/40 = 0,1
mT = mZ + mddNaOH = 60,8
→ m chất tan = 60,8.13,98% = 8,5
Phân tử chất tan có x nguyên tử Na → Mol chất tan = 0,1/x
→ M chất tan = 8,5x/0,1 = 85x
Chọn x = 1; M = 85: Chất tan là NaNO3 (0,1 mol)
→ 10,8 gam Z gồm NO2 (0,1); O2 (0,1/4 = 0,025) và H2O (0,3)
%O = 16(0,1.3 + 0,3)/(4 + 10,8) = 64,86%
Câu 36:
Hỗn hợp X gồm axit panmitic, axit stearic và triglixerit Y. Đốt cháy hoàn toàn m gam X thu được a mol CO2 và 3,04 mol H2O. Mặt khác, m gam X tác dụng tối đa với 180 ml dung dịch NaOH 1M khi đun nóng nhẹ thu được glixerol và 51,72 gam hỗn hợp gồm 2 muối. Giá trị của a bằng
 Xem đáp án
Xem đáp án
Trong X: nAxit béo tổng = b và nY = c
nNaOH = b + 3c = 0,18 (1)
Các axit béo đều no (k = 1) nên Y có k = 3
→ nY = c = (a – 3,04)/2 (2)
Bảo toàn khối lượng:
mX + mNaOH = m muối + mC3H5(OH)3 + mH2O
⇔ (12a + 3,04.2 + 0,18.32) + 0,18.40 = 51,72 + 92c + 18b (3)
(1)(2)(3) → a = 3,12; b = 0,06; c = 0,04
Câu 37:
Điện phân dung dịch chứa x mol CuSO4, y mol HCl và z mol KCl (với điện cực trơ, có màng ngăn xốp, hiệu suất điện phân là 100%). Khối lượng dung dịch giảm và khối lượng Al2O3 bị hòa tan tối đa trong dung dịch sau điện phân ứng với mỗi thí nghiệm được cho ở bảng dưới đây:
|
|
Thí nghiệm 1 |
Thí nghiệm 2 |
Thí nghiệm 3 |
|
Thời gian điện phân (giây) |
t |
2t |
3t |
|
Lượng khí sinh ra từ bình điện phân (mol) |
0,24 |
0,66 |
1,05 |
|
Khối lượng Al2O3 bị hòa tan tối đa (gam) |
6,12 |
0 |
6,12 |
Biết tại catot ion Cu2+ điện phân hết thành Cu trước khi ion H+ điện phân tạo thành khí H2, cường đi dòng điện bằng nhau và không đổi trong các thí nghiệm trên. Tổng giá trị (x + y + z) có giá trị là
 Xem đáp án
Xem đáp án
Lượng Al2O3 bị hòa tan 0,06 → 0 → 0,06 nên thời điểm t giây H+ hòa tan Al2O3, thời điểm 2t giây dung dịch không có H+, OH-, thời điểm 3t giây OH- hòa tan Al2O3 → Lúc 2t ion Cl- chưa hết.
TH1: Lúc t giây đã có H2:
Thời điểm t giây:
Catot: nCu = x và nH2 = a
Anot: nCl2 = x + a
n khí tổng = x + a + a = 0,24 (1)
Thời điểm 2t giây: ne = 4x + 4a
Catot: nCu = x và nH2 = x + 2a
Anot: nCl2 = 2x + 2a
n khí tổng = 2x + 2a + x + 2a = 0,66 (2)
(1)(2) → x = 0,18; a = 0,03
nH+ lúc t giây = y – 2a = 0,06.6 → y = 0,42
nH+ bị điện phân = 2nH2 = 2(x + 2a) = 0,48 > y: Vô lí, loại.
TH2: Lúc t giây chưa có H2:
Thời điểm t giây: nCu = nCl2 = 0,24
Thời điểm 2t giây: ne = 0,24.2.2 = 0,96
Catot: nCu = x và nH2 = 0,48 – x
Anot: nCl2 = 0,48
n khí tổng = 0,48 + 0,48 – x = 0,66 → x = 0,3
nH+ = y = 2(0,48 – x) → y = 0,36
Thời điểm 3t giây: ne = 0,24.2.3 = 1,44
Catot: nCu = 0,3 và nH2 = 0,42
Anot: nCl2 = (y + z)/2 và nO2 = p
→ y + z + 4p = 1,44
và n khí tổng = (y + z)/2 + p + 0,42 = 1,05
→ z = 0,72; p = 0,09
→ x + y + z = 1,38
Câu 38:
Bón phân NPK là yêu cầu bắt buộc khi trồng cây ăn trái. Trong giai đoạn ra hoa và nuôi trái, cây cần nhiều đạm để giúp trái phát triển, đồng thời cần kali để tăng cường vận chuyển dinh dưỡng về nuôi trái. Với một loại cây ăn trái trong giai đoạn này, người ta cần bón vào đất cho mỗi cây trung bình là 40 gam N và 65 gam K2O. Một khu vườn có diện tích 0,5 ha (1 ha = 10000m²) và mật độ trồng là 1 cây/4m², mỗi cây đã được bón 200 gam loại phân NPK 15–5–25. Để cung cấp đủ hàm lượng nitơ và kali cho các cây có trong 0,5 ha đất của khu vườn thì phải cần chuẩn bị thêm m1 kg loại phân đạm có độ dinh dưỡng 25% và m2 kg phân kali có độ dinh dưỡng 30%. Giá trị của (m1 + m2) gần nhất với?
 Xem đáp án
Xem đáp án
Phân bón dành cho 1 cây: 200 gam NPK + x gam đạm 25% + y gam kali 30%
mN = 40 = 200.15% + 25%x → x = 40 gam
mK2O = 65 = 200.25% + 30%y → y = 50 gam
Số cây trong 0,5 ha = 0,5.10000/4 = 1250 cây
m1 + m2 = 1250(x + y) = 112500 gam = 112,5 kg
Câu 39:
Khí hóa lỏng – khí gas hay còn gọi đầy đủ là khí dầu hóa lỏng LPG (Liquefied Petroleum Gas) có thành phần chính là C3H8 và C4H10 (butan). Trong đời sống, các hộ gia đình sử dụng LPG làm nhiên liệu, chất đốt trong sinh hoạt theo hình thức sử dụng bình gas 12kg. Nếu một gia đình sử dụng hết bình gas 12kg trong 45 ngày để đun nấu thì trung bình 1 ngày sẽ thải vào khí quyển lượng CO2 bao nhiêu, giả thiết loại gas có thành phần theo thể tích của propan và butan là 40% và 60%, các phản ứng xảy ra hoàn toàn.
 Xem đáp án
Xem đáp án
Chọn C
Câu 40:
Hòa tan hết 8,18 gam hỗn hợp X gồm Fe, Mg, FexOy, Mg(OH)2 và MgCO3 vào dung dịch chứa 0,19 mol H2SO4 (loãng) và 0,04 mol KNO3, thu được dung dịch Y chỉ chứa 25,18 gam các muối sunfat trung hòa và 2,24 gam hỗn hợp khí X gồm NO, CO2 và H2. Cho Y phản ứng vừa đủ với dung dịch NaOH, thu được 10,81 gam kết tủa. Mặt khác, hòa tan hết 8,18 gam X trong dung dịch HCl dư, thu được dung dịch chứa m gam muối và 0,11 mol hỗn hợp khí T có tỉ khối hơi so với H2 là 74/11. Biết các phản ứng xảy ra hoàn toàn. Giá trị gần nhất của m là
 Xem đáp án
Xem đáp án
Chọn A
