(2023) Đề thi thử Hóa Sở GD Hải Phòng (Lần 1) có đáp án
-
520 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Tiến hành thí nghiệm phản ứng của glucozơ với Cu(OH)2 theo các bước sau đây:
Bước 1: Cho vào ống nghiệm 5 giọt dung dịch CuSO4 5% và 1 ml dung dịch NaOH 10%.
Bước 2: Lắc nhẹ, gạn bỏ lớp dung dịch, giữ lại kết tủa.
Bước 3: Thêm 2 ml dung dịch glucozơ 10% vào ống nghiệm, lắc nhẹ.
Cho các nhận định sau:
(a) Sau bước 1, trong ống nghiệm xuất hiện kết tủa màu xanh.
(b) Thí nghiệm trên chứng minh phân tử glucozơ có nhiều nhóm OH liền kề.
(c) Ở thí nghiệm trên, nếu thay glucozơ bằng xenlulozơ thì thu được kết quả tương tự.
(d) Ở thí nghiệm trên, nếu thay CuSO4 bằng FeSO4 thì thu được kết quả tương tự.
(e) Ở bước 3, kết tủa bị hòa tan, dung dịch chuyển sang màu xanh tím do tạo thành phức đồng glucozơ.
Số nhận định đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Đúng
(c) Sai, xenlulozơ không phản ứng với Cu(OH)2
(d) Sai, glucozơ không tạo phức với Fe(OH)2
(e) Sai, dung dịch chuyển sang màu xanh lam.
Chọn D
Câu 2:
Cho các dung dịch: FeCl3, AgNO3, ZnSO4, HNO3 loãng. Số dung dịch phản ứng được với kim loại Cu là
 Xem đáp án
Xem đáp án
Có 3 dung dịch phản ứng được với kim loại Cu là:
FeCl3 + Cu —> FeCl2 + CuCl2
AgNO3 + Cu —> Cu(NO3)2 + Ag
HNO3 + Cu —> Cu(NO3)2 + NO + H2O
Chọn C
Câu 3:
Cho các tơ sau: tơ olon, visco, xenlulozơ axetat, tơ capron, nilon-6,6. Số tơ chứa nguyên tố N là
 Xem đáp án
Xem đáp án
Các tơ chứa N trong dãy gồm: tơ olon, tơ capron, nilon-6,6.
Chọn B
Câu 5:
Hỗn hợp E gồm axit oleic, axit stearic và triglixerit X có tỉ lệ mol tương ứng là 5 : 3 : 2. Cho m gam E tác dụng hết với dung dịch NaOH (dùng dư 25% so với lượng phản ứng), thu được hỗn hợp rắn Y gồm ba chất (trong đó natri stearat chiếm a% về khối lượng). Mặt khác, đốt cháy hoàn toàn m gam E cần dùng 3,665 mol O2 thu được 2,58 mol CO2. Giá trị của a là
 Xem đáp án
Xem đáp án
Các axit béo đều 18C nên X có dạng C57HxO6
Đặt nC17H33COOH = 5e; nC17H35COOH = 3e và nX = 2e
—> nCO2 = 18.5e + 18.3e + 57.2e = 2,58
—> e = 0,01
nO2 = 25,5.5e + 26.3e + 2e(0,25x + 54) = 3,665
—> x = 106
X là (C17H33COO)2(C17H35COO)C3H5
Y chứa C17H33COONa (0,09), C17H35COONa (0,05)
—> nNaOH phản ứng = 0,14 —> nNaOH dư = 0,035
—> %C17H35COONa = 34,725%
Chọn A
Câu 7:
Hai chất E và F là đồng phân cấu tạo của nhau. Đốt cháy hoàn toàn E (no, mạch hở, ME < 180), thu được số mol CO2 bằng với số mol O2 đã tham gia phản ứng. Từ E, F thực hiện sơ đồ phản ứng sau:
E + H2O → X + Y
F + H2O → X + Z + T
Biết: E, F chỉ chứa chức este trong phân tử. Y, T đều là ancol trong đó chỉ có Y hòa tan được Cu(OH)2.
Cho các phát biểu sau:
(a) T tan vô hạn trong nước.
(b) 1 mol X tác dụng với dung dịch AgNO3 trong NH3 dư, thu được tối đa 4 mol Ag.
(c) E là este no, ba chức, mạch hở.
(d) Có 2 đồng phân cấu tạo thỏa mãn chất F.
(e) Sục khí propilen vào dung dịch KMnO4, thu được chất hữu cơ Y.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đốt E có nCO2 = nO2 nên E có dạng Cn(H2O)m
Theo các phản ứng thủy phân thì E có ít nhất 4 oxi trong phân tử, ME < 180 —> E là C5H8O4
Y là ancol 2 chức nên E là (HCOO)2C3H6
X là HCOONa; Y là CH3-CHOH-CH2OH
F có các cấu tạo:
HCOO-CH2COO-CH2CH3
HCOO-CH2CH2COO-CH3
HCOO-CH(CH3)-COO-CH3
Z là HO-CH2COOH; HO-CH2CH2COOH; CH3CHOH-COOH
T là CH3OH hoặc C2H5OH
(a) Đúng
(b) Sai, 1 mol X tạo tối đa 2 mol Ag
(c) Sai, E là este no, 2 chức, mạch hở
(d) Sai, F có 3 đồng phân cấu tạo thỏa mãn
(e) Đúng: CH3-CH=CH2 + KMnO4 + H2O —> CH3CHOH-CH2OH + KOH + MnO2
Chọn D
Câu 8:
Cho 0,1 mol Glu-Ala tác dụng với dung dịch KOH dư, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, số mol KOH đã phản ứng là
 Xem đáp án
Xem đáp án
Glu-Ala + 3KOH —> GluK2 + AlaK + 2H2O
nGlu-Ala = 0,1 —> nKOH = 0,3
Chọn B
Câu 10:
Cho 1,18 gam hỗn hợp X gồm C, P, S vào dung dịch chứa 0,3 mol HNO3 đặc, nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,26 mol hỗn hợp khí X gồm CO2 và NO2 (sản phẩm khử duy nhất) và dung dịch Y. Hấp thụ hoàn toàn X vào dung dịch Ba(OH)2 dư thu được 3,94 gam một chất kết tủa. Mặt khác, khi cho 100 ml dung dịch chứa KOH 1M và NaOH 1M vào dung dịch Y thu được dung dịch Z. Cô cạn Z được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
nC = nCO2 = nBaCO3 = 0,02
—> nNO2 = 0,26 – nCO2 = 0,24 < nHNO3 = 0,3 nên HNO3 còn dư (0,06 mol) —> X tan hết.
Đặt nP = a và nS = b
—> mX = 0,02.12 + 31a + 32b = 1,18
Bảo toàn electron: 0,02.4 + 5a + 6b = 0,24
—> a = 0,02; b = 0,01
Y chứa HNO3 dư (0,06), H2SO4 (0,01) và H3PO4 (0,02) —> nH+ max = 0,14
nNaOH = nKOH = 0,1 —> nOH- = 0,2 > 0,14 nên kiềm còn dư —> nH2O = 0,14
Bảo toàn khối lượng:
mHNO3 dư + mH2SO4 dư + mH3PO4 + mNaOH + mKOH = m rắn + mH2O
—> m rắn = 13,8
Chọn A
Câu 12:
Cho các phát biểu sau:
(a) Dầu ăn và mỡ động vật có chứa nhiều triglixerit.
(b) Giấm ăn được sử dụng để làm giảm mùi tanh của cá.
(c) Nước ép quả nho chín có phản ứng tráng bạc.
(d) Tơ tằm bền trong môi trường axit và môi trường kiềm.
(e) Cao su lưu hóa có tính đàn hồi, lâu mòn hơn cao su thường.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Đúng, giấm ăn chứa axit (CH3COOH) tác dụng với chất gây mùi tanh (amin) thành dạng muối, dễ bị hòa tan và rửa trôi.
(c) Đúng, nước ép nho chín chứa glucozơ
(d) Sai, tơ tằm chứa -CONH- kém bền trong axit và kiềm.
(e) Đúng
Chọn C
Câu 13:
Cho hỗn hợp gồm 2,34 gam Al và m gam Fe vào dung dịch chứa Cu(NO3)2 0,8M và AgNO3 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và hỗn hợp rắn Y. Cho toàn bộ Y vào dung dịch HCl loãng, dư thu được 1,792 lít khí H2 (đktc) và 23,88 gam rắn không tan. Giá trị của m là
 Xem đáp án
Xem đáp án
nH2 = 0,08 —> nFe dư = 0,08
Do có Fe dư nên các muối Cu(NO3)2 (0,8x) và AgNO3 (x) đã phản ứng hết.
—> 64.0,8x + 108x = 23,88
—> x = 0,15
Bảo toàn electron: 3nAl + 2nFe phản ứng = 2nCu2+ + nAg+
—> nFe phản ứng = 0,065
—> mFe = 56(0,08 + 0,065) = 8,12
Chọn A
Câu 14:
Để bảo vệ vỏ tàu biển bằng thép người ta thường gắn vỏ tàu (phần ngoài ngâm dưới nước) những tấm kim loại nào sau?
 Xem đáp án
Xem đáp án
Để bảo vệ vỏ tàu biển làm bằng thép (thành phần chính là Fe) người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại Zn vì Zn có tính khử mạnh hơn Fe nên Zn là cực âm và bị ăn mòn, Fe là cực dương và được bảo vệ.
Chọn B
Câu 16:
Chất nào sau đây phản ứng dung dịch NaOH tạo khí H2?
 Xem đáp án
Xem đáp án
A. AlCl3 + NaOH —> Al(OH)3 + NaCl
B. Al(OH)3 + NaOH —> NaAlO2 + H2O
C. Al + H2O + NaOH —> NaAlO2 + H2
D. NaHCO3 + NaOH —> Na2CO3 + H2O
Chọn C
Câu 17:
Hòa tan hết 5,76 gam hỗn hợp rắn X gồm Al và Al2O3 trong dung dịch HCl loãng dư, thu được 3,36 lít khí H2 (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được lượng muối khan là
 Xem đáp án
Xem đáp án
nH2 = 0,15 —> nAl = 0,1
nAl2O3 = (mX – mAl)/102 = 0,03
Bảo toàn Al —> nAlCl3 = 0,16
—> mAlCl3 = 21,36 gam
Chọn B
Câu 20:
Dung dịch X chứa Na2CO3 và NaOH. Dung dịch Y chứa Ca(HCO3)2 0,25M và NaHCO3 0,25M. Trộn X và Y thu được 4 gam kết tủa và 360ml dung dịch Z. Nhỏ từ từ từng giọt dung dịch HCl 1M vào 360ml Z, sự phụ thuộc số mol khí vào thể tích dung dịch HCl được mô tả như đồ thị hình bên.
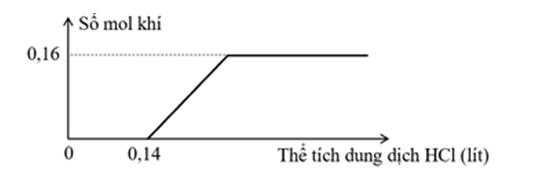
Coi thể tích dung dịch không đổi, các phản ứng xảy ra hoàn toàn. Nồng độ NaOH trong dung dịch X là
 Xem đáp án
Xem đáp án
nHCl khi bắt đầu tạo khí = 0,14 < n khí = 0,16 nên Z gồm Na2CO3 (0,14) và NaHCO3 (0,16 – 0,14 = 0,02)
nCa(HCO3)2 = nCaCO3 = 0,04 —> nNaHCO3 = 0,04
—> VY = 0,16 lít —> VX = VZ – VY = 0,2 lít
X chứa Na2CO3 (x) và NaOH (y)
Bảo toàn Na —> 2x + y + 0,04 = 0,14.2 + 0,02
Bảo toàn C —> x + 0,04.2 + 0,04 = 0,04 + 0,16
—> x = 0,08; y = 0,1
—> CM NaOH = 0,1/0,2 = 0,5M
Chọn A
Câu 21:
Phản ứng hóa học nào sau đây không có phương trình ion thu gọn: H+ + OH- → H2O?
 Xem đáp án
Xem đáp án
A, B, D: H+ + OH- → H2O
C. Fe(OH)2 + 2H+ → Fe2+ + 2H2O
Chọn C
Câu 23:
Chia hỗn hợp A gồm Fe3O4, Fe2O3, FeO, Fe(OH)3 và FeCO3 thành hai phần. Hòa tan hoàn toàn phần 1 bằng 210 ml dung dịch HCl 1M (vừa đủ), thu được 0,448 lít khí và dung dịch B, cô cạn dung dịch B thu được m gam muốiC. Cho phần 2 tác dụng với lượng dư dung dịch H2SO4 đặc, nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch D và 2,24 lít hỗn hợp khí T gồm CO2 và SO2 (sản phẩm khử duy nhất của S+6) có tỉ khối so với H2 bằng 28, các khí đo ở điều kiện tiêu chuẩn. Phần trăm khối lượng của FeCl2 có trong C gần nhất với giá trị nào sau đây?.
 Xem đáp án
Xem đáp án
Phần 2 + H2SO4 đặc nóng dư —> T gồm CO2 (0,04) và SO2 (0,06)
Phần 1 + HCl —> nCO2 = 0,02 —> Phần 1 bằng nửa phần 2.
Quy đổi phần 1 thành Fe (a), O (b), CO2 (0,02) và H2O
nHCl = 0,21 —> nH2O = b = 0,105
Bảo toàn electron cho phần 2:
3.2a = 2.2b + 2nSO2 —> a = 0,09
C gồm FeCl2 (u) và FeCl3 (v)
Bảo toàn Fe —> u + v = 0,09
Bảo toàn Cl —> 2u + 3v = 0,21
—> u = 0,06; v = 0,03
—> %FeCl2 = 60,98%
Chọn C
Câu 24:
Nhỏ dung dịch NaOH đến dư vào dung dịch X ta thu được kết tủa trắng. Chất tan trong dung dịch X là
 Xem đáp án
Xem đáp án
A. AlCl3 + NaOH dư —> NaAlO2 + NaCl + H2O
B. Ca(HCO3)2 + NaOH dư —> CaCO3 (trắng) + Na2CO3 + H2O
C. Zn(NO3)2 + NaOH dư —> Na2ZnO2 + NaNO3 + H2O
D. CuSO4 + NaOH dư —> Cu(OH)2 (xanh) + Na2SO4
Chọn B
Câu 25:
Natri hidrocacbonat có nhiều ứng dụng trong thực tế như dùng làm thuốc chữa bệnh đau dạ dầy, làm bột nở. Công thức phân tử Natri hidrocacbonat là
 Xem đáp án
Xem đáp án
Chọn C
Câu 26:
Chất nào sau đây không dùng để làm mềm nước có tính cứng tạm thời?
 Xem đáp án
Xem đáp án
NaNO3 không dùng để làm mềm nước có tính cứng tạm thời vì không loại bỏ được Mg2+, Ca2+ ra khỏi dung dịch.
Chọn A
Câu 27:
Điều nhận định nào sau đây là đúng?
 Xem đáp án
Xem đáp án
A. Sai, Be không phản ứng, Mg phản ứng chậm với nước ở điều kiện thường.
B. Sai, Na khử H2O trước:
Na + H2O —> NaOH + H2
NaOH + CuSO4 —> Cu(OH)2 + Na2SO4
C. Sai, nước mềm là nước không chứa hoặc chứa ít cation Ca2+ và Mg2+.
D. Đúng, Li nhẹ hơn nước.
Chọn D
Câu 32:
X và Y là hai cacbohiđrat. X là chất rắn, ở dạng bột vô định hình, màu trắng, không tan trong nước lạnh. Y là loại đường phổ biến nhất, có trong nhiều loài thực vật, có nhiều nhất trong cây mía, củ cải đường và hoa thốt nốt. Tên gọi của X, Y lần lượt là
 Xem đáp án
Xem đáp án
X và Y là hai cacbohiđrat. X là chất rắn, ở dạng bột vô định hình, màu trắng, không tan trong nước lạnh —> X là tinh bột.
Y là loại đường phổ biến nhất, có trong nhiều loài thực vật, có nhiều nhất trong cây mía, củ cải đường và hoa thốt nốt —> Y là saccarozơ.
Chọn A
Câu 33:
Để khử khuẩn ta nên rửa tay nhiều lần bằng xà phòng hoặc các dung dịch sát khuẩn có pha thành phần chất X. Trong công nghiệp, chất X có thể pha chế thêm vào xăng để tạo ra nhiêu liệu xăng sinh học E5. Chất X là
 Xem đáp án
Xem đáp án
Chọn D
Câu 34:
Thực hiện các thí nghiệm sau:
(a) Sục từ từ khí CO2 đến dư vào dung dịch Ba(OH)2.
(b) Cho NaHCO3 vào dung dịch Ca(OH)2.
(c) Cho MgCl2 vào dung dịch NaHCO3.
(d) Đun nóng nước cứng tạm thời.
(e) Cho dung dịch NH3 dư vào dung dịch AlCl3.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
(a) CO2 + Ba(OH)2 —> BaCO3 + H2O
CO2 + H2O + BaCO3 —> Ba(HCO3)2
(b) NaHCO3 + Ca(OH)2 —> CaCO3 + NaOH + H2O
(c) Không phản ứng
(d) M(HCO3)2 —> MCO3 + CO2 + H2O (M là Mg, Ca)
(e) NH3 dư + H2O + AlCl3 —> Al(OH)3 + NH4NO3
Chọn B
Câu 35:
Hỗn hợp X gồm một axit cacboxylic hai chức, một este đơn chức và một este hai chức (trong phân tử mỗi chất chỉ chứa một loại nhóm chức). Đốt cháy hoàn toàn 24,34 gam X bằng lượng oxi vừa đủ, thu được 37,84 gam CO2 và 8,1 gam H2O. Nếu đun nóng 24,34 gam X với dung dịch NaOH vừa đủ, thu được hỗn hợp Y gồm hai ancol no, đơn chức, mạch hở kế tiếp nhau trong dãy đồng đẳng và hỗn hợp Z gồm các muối (phân tử đều không chứa nhóm –OH). Dẫn toàn bộ Y qua bình đựng Na dư, thấy khối lượng bình tăng 2,28 gam. Đốt cháy hoàn toàn Z cần dùng 0,54 mol O2, thu được CO2, H2O và 24,38 gam Na2CO3. Phần trăm khối lượng của este hai chức trong hỗn hợp X là
 Xem đáp án
Xem đáp án
nCO2 = 0,86; nH2O = 0,45
—> nO(X) = (mX – mC – mH)/16 = 0,82
nNa2CO3 = 0,23 —> nNaOH = 0,46
nCOO-Phenol = u và nCOOH + nCOO-Ancol = v
—> 2u + 2v = 0,82 và 2u + v = 0,46
—> u = 0,05; v = 0,36
Bảo toàn khối lượng —> nO2 đốt X = 0,675
—> nO2 đốt Y = 0,675 – 0,54 = 0,135
Quy đổi Y thành CH3OH (a) và CH2 (b)
—> nO2 = 1,5a + 1,5b = 0,135
m tăng = 31a + 14b = 2,28
—> a = 0,06; b = 0,03
—> Ancol gồm CH3OH (0,03) và C2H5OH (0,03)
nCOO-Ancol = a —> nCOOH = v – a = 0,3
X gồm:
A(COOH)2: 0,3/2 = 0,15 mol
B(COOCH3)(COOC2H5): 0,03 mol
RCOOP: 0,05 mol
mX = 0,15(A + 90) + 0,03(B + 132) + 0,05(R + P + 44) = 24,34
—> 15A + 3B + 5R + 5P = 468
Với P ≥ 77 —> A = 0, B = 26, R = 1, P = 77 là nghiệm duy nhất.
X gồm:
(COOH)2: 0,15 mol
C2H2(COOCH3)(COOC2H5): 0,03 mol —> Chiếm 19,47%
HCOOC6H5: 0,05 mol
Chọn D
Câu 37:
Xà phòng hóa hoàn toàn 10,88 gam phenyl axetat (CH3COOC6H5) bằng 200ml dung dịch KOH 1,0M thu được dung dịch X. Cô cạn X ta thu được m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
CH3COOC6H5 + 2KOH —> CH3COOK + C6H5OK + H2O
nCH3COOC6H5 = 0,08; nKOH = 0,2 —> nH2O = 0,08
Bảo toàn khối lượng:
mCH3COOC6H5 + mKOH = m rắn + mH2O
—> m rắn = 20,64 gam
Chọn D
Câu 38:
Điện phân (điện cực trơ, màng ngăn xốp) dung dịch gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1 : 3) với cường độ dòng điện 2,68A. Sau thời gian t giờ, thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 20,75 gam so với dung dịch ban đầu. Cho bột Al dư vào Y, thu được 3,36 lít khí H2. Biết các phản ứng xảy ra hoàn toàn, hiệu suất điện phân 100%, bỏ qua sự bay hơi của nước. Giá trị của t là.
 Xem đáp án
Xem đáp án
Ban đầu: nCuSO4 = x; nNaCl = 3x
—> Y chứa 2 chất tan gồm Na2SO4 (x) và NaOH (x)
nH2 = 0,15 —> nNaOH = x = 0,1
Catot: nCu = 0,1; nH2 = a
Anot: nCl2 = 0,15; nO2 = b
Bảo toàn electron: 2.0,1 + 2a = 0,15.2 + 4b
m giảm = 0,1.64 + 2a + 0,15.71 + 32b = 20,75
—> a = 0,25; b = 0,1
—> ne = 2.0,1 + 2a = It/F —> t = 25205s = 7h
Chọn C
Câu 40:
Thủy phân hoàn toàn 1 mol peptit mạch hở X, thu được 1 mol Gly, 2 mol Ala và 2 mol Val. Mặt khác, thủy phân không hoàn toàn X, thu được hỗn hợp các amino axit và các peptit (trong đó có Gly-Ala-Val). Số công thức cấu tạo phù hợp với tính chất trên của X là?
 Xem đáp án
Xem đáp án
Các cấu tạo của X:
Gly-Ala-Val-Ala-Val
Gly-Ala-Val-Val-Ala
Ala-Gly-Ala-Val-Val
Val-Gly-Ala-Val-Ala
Ala-Val-Gly-Ala-Val
Val-Ala-Gly-Ala-Val
Chọn C
