(2023) Đề thi thử Hóa Sở giáo dục đào tạo Hải Phòng (Lần 1) có đáp án
(2023) Đề thi thử Hóa Sở giáo dục đào tạo Hải Phòng (Lần 1) có đáp án
-
301 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 4:
Kim loại nào sau đây dẫn điện tốt nhất?
 Xem đáp án
Xem đáp án
Độ dẫn điện: Ag > Cu > Au > Al > Fe → Kim loại dẫn điện tốt nhất là Ag.
Câu 5:
Trong điều kiện không có oxi, sắt phản ứng với lượng dư dung dịch nào sau đây sinh ra muối sắt(II)?
 Xem đáp án
Xem đáp án
A. H2SO4 đặc, nóng + Fe → Fe2(SO4)3 + SO2 + H2O
B. HCl loãng + Fe → FeCl2 + H2
C. Cl2 + Fe → FeCl3
D. HNO3 loãng + Fe → Fe(NO3)3 + NO + H2O
Câu 7:
Điện phân dung dịch CuSO4, ở catot thu được chất nào sau đây?
 Xem đáp án
Xem đáp án
Điện phân dung dịch CuSO4, ở catot thu được Cu:
CuSO4 + H2O → Cu (catot) + O2 (anot) + H2SO4
Câu 9:
Chất nào sau đây là muối trung hòa?
 Xem đáp án
Xem đáp án
NaCl là muối trung hòa do gốc axit không còn khả năng nhường proton.
Câu 11:
Cho thanh kim loại Cu vào dung dịch chất nào sau đây sẽ xảy ra hiện tượng ăn mòn điện hóa học?
 Xem đáp án
Xem đáp án
Cu + AgNO3 → Cu(NO3)2 + Ag
Ag sinh ra bám vào thanh Cu tạo cặp điện cực Cu-Ag, tiếp xúc với nhau và cùng tiếp xúc với môi trường điện li nên có ăn mòn điện hóa.
Câu 12:
Dung dịch chất nào sau đây hòa tan được Al(OH)3?
 Xem đáp án
Xem đáp án
Dung dịch HCl hòa tan được Al(OH)3:
HCl + Al(OH)3 → AlCl3 + H2O
Câu 15:
Quá trình đốt nhiên liệu hóa thạch sinh ra nhiều chất khí gây ô nhiễm không khí, trong đó có khí X (không màu, mùi hắc) là nguyên nhân chính gây ra hiện tượng mưa axit. Khí X là
 Xem đáp án
Xem đáp án
Chọn B
Câu 16:
Khi kiểm tra nồng độ cồn bằng máy đo, crom(VI) oxit oxi hóa ancol etylic thành hợp chất màu xanh đen. Công thức của crom (VI) oxit là?
 Xem đáp án
Xem đáp án
Chọn A
Câu 17:
Trong phản ứng của kim loại Ca với Cl2, một nguyên tử Ca nhường bao nhiêu electron?
 Xem đáp án
Xem đáp án
Trong phản ứng của kim loại Ca với khí Cl2, một nguyên tử Ca nhường 2 electron:
Ca → Ca2+ + 2e
Câu 19:
Thực hiện phản ứng chuyển hóa sau:
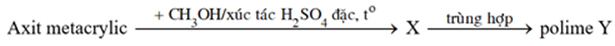
Tên gọi của Y là
 Xem đáp án
Xem đáp án
X là CH2=C(CH3)-COOCH3
Y là (-CH2-C(CH3)(COOCH3)-)n (Poli (metyl metacrylat))
Câu 20:
Phản ứng hóa học nào sau đây sai?
 Xem đáp án
Xem đáp án
Phản ứng D sai, Fe có tính khử yếu hơn Zn nên Fe không khử được Zn2+.
Câu 21:
Tinh thể chất rắn X không màu, vị ngọt, dễ tan trong nước. X có nhiều trong quả nho chín nên còn gọi là đường nho. Khử chất X bằng H2 thu được chất hữu cơ Y. Tên gọi của X và Y lần lượt là?
 Xem đáp án
Xem đáp án
X có nhiều trong quả nho chín nên còn gọi là đường nho → X là Glucozơ
X + H2 → Y nên Y là sobitol.
Câu 22:
Để tráng bạc lên một tấm kính hình chữ nhật trung bình cần 5 gam Ag. Để tráng bạc lên 1000 tấm kính trên người ta phải dùng V lít dung dịch glucozơ 1M. Biết hiệu suất tráng bạc là 80%. Giá trị của V là
 Xem đáp án
Xem đáp án
nAg = 1000.5/108 = 46,296 mol
→ nC6H12O6 cần dùng = 46,296/(2.80%) = 28,935 mol
→ V = 28,935 lít
Câu 24:
Cho 9,85 gam hỗn hợp 2 amin, đơn chức, bậc 1 tác dụng vừa đủ với dung dịch HCl thu được 18,975 gam muối. Khối lượng HCl phải dùng là
 Xem đáp án
Xem đáp án
Bảo toàn khối lượng:
mHCl = 18,975 – 9,85 = 9,125 gam
Câu 25:
Dẫn một luồng khí CO qua ống sứ đựng m gam hỗn hợp CuO, Fe2O3, Fe3O4 và Al2O3 rồi cho khí thoát ra hấp thụ hết vào dung dịch nước vôi trong dư thu được 15 gam kết tủa. Chất rắn còn lại trong ống sứ có khối lượng 215,0 gam. Giá trị của m là
 Xem đáp án
Xem đáp án
nO bị lấy = nCO2 = nCaCO3 = 0,15
→ m = 215 + 0,15.16 = 217,4 gam
Câu 26:
Hòa tan hoàn toàn 11,0 gam hỗn hợp X gồm Zn và Cu bằng dung dịch H2SO4 loãng dư, thu được 0,12 mol khí H2. Số mol Cu trong 11,0 gam X là
 Xem đáp án
Xem đáp án
Trong X chỉ có Zn tác dụng với H2SO4
→ nZn = nH2 = 0,12
→ nCu = (mX – mZn)/64 = 0,05 mol
Câu 27:
Một mẫu nước cứng có chứa các ion: Ca2+, Mg2+, HCO3-, Cl-, SO42-. Chất có khả năng làm mềm mẫu nước cứng trên là
 Xem đáp án
Xem đáp án
Chất có khả năng làm mềm mẫu nước cứng trên là Na2CO3, vì:
Ca2+ + CO32- → CaCO3
Mg2+ + CO32- → MgCO3
Câu 28:
Thực hiện thí nghiệm như hình vẽ sau:
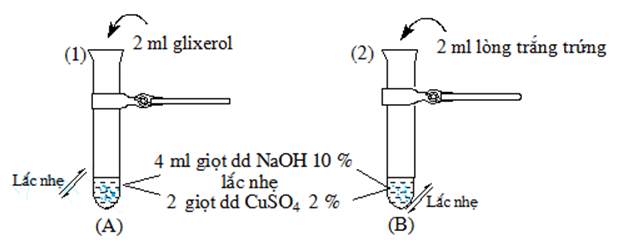
Sau khi lắc nhẹ, rồi để yên thì thấy tại ống nghiệm (A) và (B) lần lượt xuất hiện dung dịch
 Xem đáp án
Xem đáp án
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
(A): Glyxerol + Cu(OH)2 → Phức màu xanh lam
(B): Lòng trắng trứng + Cu(OH)2 → Phức màu tím
Câu 29:
Khi trồng mía, ngoài vôi và phân chuồng, người nông dân còn bón cả phân hoá học cho đất. Để đạt năng suất từ 90 – 100 tấn/1ha ở mỗi vụ mía tơ, cần bón cho mỗi hecta đất 230,4 kg nitơ, 39,7848 kg P; 179,234 kg K. Các loại phân hoá học mà người nông dân sử dụng là ure (độ dinh dưỡng 46%); phân lân nung chảy (90% Ca3(PO4)2); NPK 15-5-27. Các tạp chất còn lại không chứa các nguyên tố N, P, K. Tổng khối lượng phân bón đã sử dụng cho 5 ha đất có giá trị là
 Xem đáp án
Xem đáp án
Các loại phân đã dùng cho 1 ha đất gồm ure (x kg); phân lân nung chảy (y kg); NPK (z kg)
mN = 230,4 = 46%x + 15%z
mP = 39,7848 = 31.2.90%y/310 + 31.2.5%z/142
mK = 179,234 = 39.2.27%z/94
→ x = 240; y = 124; z = 800
→ x + y + z = 1164
→ Với 5 ha đất cần 1164.5 = 5820 kg phân
Câu 30:
Xà phòng hóa 7,4 gam metyl axetat bằng 200 ml dung dịch KOH 0,8M. Sau khi phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được chất rắn khan có khối lượng là:
 Xem đáp án
Xem đáp án
CH3COOCH3 + KOH → CH3COOK + CH3OH
nCH3COOCH3 = 0,1; nKOH = 0,16 → Chất rắn gồm CH3COOK (0,1) và KOH dư (0,06)
→ m rắn = 13,16 gam
Câu 31:
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch Ba(HCO3)2 vào dung dịch KHSO4.
(b) Cho K vào dung dịch CuSO4 dư.
(c) Cho dung dịch NH4NO3 vào dung dịch Ba(OH)2.
(d) Cho dung dịch HCl tới dư vào dung dich C6H5ONa.
(e) Cho dung dịch CO2 tới dư vào dung dịch gồm NaOH và Ca(OH)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả chất rắn và khí là
 Xem đáp án
Xem đáp án
(a) Ba(HCO3)2 + KHSO4 → BaSO4 + K2SO4 + CO2 + H2O
(b) K + H2O → KOH + H2
KOH + CuSO4 → K2SO4 + Cu(OH)2
(c) NH4NO3 + Ba(OH)2 → Ba(NO3)2 + NH3 + H2O
(d) HCl + C6H5ONa → C6H5OH + NaCl
(e) CO2 dư + Ca(OH)2 → Ca(HCO3)2
CO2 dư + NaOH → NaHCO3
Câu 32:
Cho kim loại Fe lần lượt phản ứng với dung dịch các chất riêng biệt sau: H2SO4 loãng, CuCl2, Fe(NO3)2, AgNO3, NaCl. Số trường hợp có phản ứng hóa học xảy ra là
 Xem đáp án
Xem đáp án
Có 3 trường hợp xảy ra phản ứng:
Fe + H2SO4 loãng → FeSO4 + H2
Fe + CuCl2 → FeCl2 + Cu
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Câu 33:
Cho các phát biểu sau :
(a) Ở điều kiện thường, chất béo (C17H33COO)3C3H5 ở trạng thái lỏng.
(b) Fructozơ là monosaccarit duy nhất có trong mật ong.
(c) Thành phần dầu mỡ bôi trơn xe máy có thành phần chính là chất béo.
(d) Thành phần chính của giấy chính là xenlulozơ.
(e) Amilozơ và amilopectin đều cấu trúc mạch phân nhánh.
(f) Dầu chuối (chất tạo hương liệu mùi chuối chín) có chứa isoamyl axetat.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng, (C17H33COO)3C3H5 là chất béo không no nên ở trạng thái lỏng.
(b) Sai, mật ong chứa nhiều fructozo và glucozo
(c) Sai, dầu mỡ bôi trơn có thành phần hidrocacbon
(d) Đúng
(e) Sai, amilozo không nhánh
(f) Đúng
Câu 34:
Xăng sinh học E5 chứa 5% etanol về thể tích (D = 0,8 g/ml), còn lại là xăng truyền thống, giả thiết xăng truyền thống chỉ chứa hai ankan là C8H18 và C9H20 có tỉ lệ mol tương ứng là 4 : 3; D = 0,7 g/ml). Khi được đốt cháy hoàn toàn, 1 mol etanol tỏa ra lượng nhiệt là 1365 kJ, 1 mol C8H18 tỏa ra lượng nhiệt là 5072 kJ và 1 mol C9H20 tỏa ra nhiệt lượng là 6119 kJ. Trung bình, một chiếc xe máy tay ga di chuyển được 1 km thì cần một nhiệt lượng chuyển thành công cơ học có độ lớn là 212 kJ. Nếu xe máy tay ga đó đã sử dụng hết 6,5 lít xăng E5 ở trên thì quãng đường xe di chuyển được là (biết hiệu suất sử dụng nhiên liệu của động cơ là 40%)
 Xem đáp án
Xem đáp án
nC2H5OH = 6500.5%.0,8/46 = 5,6522 mol
nC8H18 = 4x; nC9H20 = 3x
→ 6500.95%.0,7 = 114.4x + 128.3x → x = 5,1458
Xe chạy được y km thì hết 6,5 lít xăng, bảo toàn năng lượng:
(5,6522.1365 + 5072.4x + 6119.3x).40% = 212y
→ y ≈ 390 km
Câu 35:
Đun nóng m gam hỗn hợp E gồm Al, Fe3O4 và MO có tỉ lệ tương ứng 5 : 1 : 2 (biết nguyên tố oxi chiếm 18,2163% khối lượng trong E) trong khí trơ thu được hỗn hợp rắn F. Chia F thành hai phần. Phần 1 tác dụng với NaOH dư thu được 1,68 lít khí H2. Phần 2 cho tác dụng hết với dung dịch chứa H2SO4 đặc, nóng, thu được 0,75 mol SO2 (sản phẩm khử duy nhất của S+6) và dung dịch G chỉ chứa 172,7 gam muối sunfat trung hòa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
mO = 16(4 + 2) = 18,2163%(27.5 + 232 + 2M + 32)
→ M = 64: M là Cu
E gồm Al (5x), Fe3O4 (x) và CuO (2x)
→ F gồm Fe (3x), Cu (2x), Al2O3 (2x) và Al dư (x)
Phần 2 gồm Fe (3y), Cu (2y), Al2O3 (2y) và Al dư (y)
nSO42- (muối) = (2nSO2 + 2nO)/2 = 6y + 0,75
→ m muối = 27.5y + 56.3y + 64.2y + 96(6y + 0,75) = 172,7
→ y = 0,1
→ m phần 2 = 52,7
Phần 1: nH2 = 0,075 → nAl dư = 0,05
Phần 2 có nAl dư = 0,1 = 2 lần phần 1 nên:
m = 52,7 + 52,7/2 = 79,05
Câu 36:
Điện phân dung dịch chứa x mol CuSO4, y mol H2SO4 và z mol NaCl (với điện cực trơ, có màng ngăn xốp, hiệu suất điện phân là 100%, cường độ dòng điện 5A). Khối lượng Al2O3 bị hòa tan tối đa trong dung dịch sau điện phân ứng với mỗi thí nghiệm được cho ở đồ thị sau:
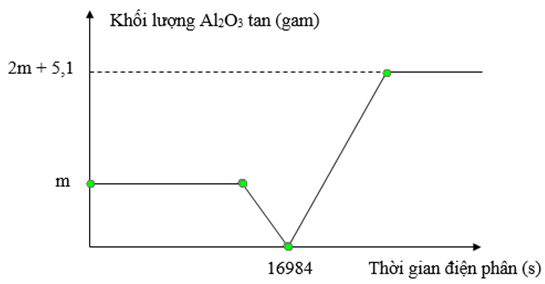
Biết (x + y + z) = 1,74. Tại thời điểm t (giây) thu được tổng số mol khí ở hai điện cực là 1,25 mol. Giá trị của t là
 Xem đáp án
Xem đáp án
Đoạn 1:
CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
x…………..2x…….x…….x
nH2SO4 = y → nAl2O3 (ứng với m gam) = y/3
Đoạn 2:
H2SO4 + 2NaCl → H2 + Cl2 + Na2SO4
y………….2y……y…….y
Kết thúc đoạn 2 thì ne = 16984.5/96500 = 0,88
→ 2x + 2y = 0,88 (1)
Đoạn 3:
2H2O + 2NaCl → H2 + Cl2 + 2NaOH
nNaCl còn lại = z – (2x + 2y) = z – 0,88
→ nNaOH = z – 0,88
nAl2O3 = 2y/3 + 0,05 = (z – 0,88)/2 (2)
(1)(2) và x + y + z = 1,74 → x = 0,2; y = 0,24; z = 1,3
Kết thúc đoạn 3 thu n khí = x + 2y + (z – 0,88) = 1,1 < 1,25 nên H2O bị điện phân tiếp tạo 1,25 – 1,1 = 0,15 mol H2, O2 → nH2 = 0,1 và nO2 = 0,05
ne anot = z + 0,05.4 = It/F → t = 28950s
Câu 37:
Cho sơ đồ chuyển hóa sau:
(1) X1 + X2 → X3 + X4 + H2O.
(2) X1 + 2X2 → X3 + X5 + 2H2O
(3) X1 + X5 → X3 + 2X4
Trong dãy các cặp chất sau: (a) Ba(HCO3)2 và NaOH; (b) Ba(OH)2 và NaHCO3; (c) Ba(HCO3)2 và NaHSO4; (d) Ba(OH)2 và NaH2PO4, số cặp chất thỏa mãn với X1 và X2 trong sơ đồ trên là
 Xem đáp án
Xem đáp án
(a) Ba(HCO3)2 và NaOH
Ba(HCO3)2 + NaOH → BaCO3 + NaHCO3 + H2O
Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O
Ba(HCO3)2 + Na2CO3 → BaCO3 + 2NaHCO3
(b) Ba(OH)2 và NaHCO3
Ba(OH)2 + NaHCO3 → BaCO3 + NaOH + H2O
Ba(OH)2 + 2NaHCO3 → BaCO3 + Na2CO3 + 2H2O
Ba(OH)2 + Na2CO3 → BaCO3 + 2NaOH
(c) Ba(HCO3)2 và NaHSO4
Ba(HCO3)2 + NaHSO4 → BaSO4 + NaHCO3 + CO2 + H2O
Có khí CO2 nên sai ngay phản ứng đầu tiên.
(d) Ba(OH)2 và NaH2PO4
3Ba(OH)2 + 3NaH2PO4 → Ba3(PO4)2 + Na3PO4 + 6H2O
Không phù hợp tỉ lệ của phản ứng (1)
Câu 38:
Hỗn hợp E gồm chất X (C2H10N2O3, muối của axit vô cơ), chất Y (C3H10O2N2, muối của α-amino axit) và chất Z (C9H16O5N4, tetrapeptit mạch hở). Cho E tác dụng hoàn toàn với dung dịch NaOH (đun nóng), thu được hỗn hợp khí G. Cho E tác dụng hoàn toàn với dung dịch H2SO4 (loãng, dư, đun nóng), thu được khí T và dung dịch Q. Cho các nhận định sau:
(a) Chất Z có 4 công thức cấu tạo thỏa mãn.
(b) Chất T là nguyên liệu sản xuất một loại phân đạm có hàm lượng dinh dưỡng cao.
(c) Hỗn hợp G chứa 2 khí đều tác dụng được với dung dịch FeCl3.
(d) Dung dịch Q chứa 4 chất tan.
(e) Chất Y có 2 công thức cấu tạo thỏa mãn.
Số nhận định đúng là
 Xem đáp án
Xem đáp án
Cấu tạo của X: CH3NH3-CO3-NH4
Cấu tạo của Y:
H2N-CH2-COO-NH3-CH3
H2N-CH(CH3)-COO-NH4
Z dạng (Gly)3Ala
G gồm NH3, CH3NH2; T là CO2
Q chứa: CH3NH3HSO4; NH4HSO4; HOOC-CH2-NH3HSO4; HOOC-CH(CH3)-NH3HSO4, H2SO4 dư.
(a) Đúng, Z có 4 công thức cấu tạo thỏa mãn:
Gly-Gly-Gly-Ala
Gly-Gly-Ala-Gly
Gly-Ala-Gly-Gly
Ala-Gly-Gly-Gly
(b) Đúng, từ CO2, NH3 điều chế ra urê (NH2)2CO.
(c) Đúng:
NH3 + H2O + FeCl3 → Fe(OH)3 + NH4Cl
CH3NH2 + H2O + FeCl3 → Fe(OH)3 + CH3NH3Cl
(d) Sai, Q chứa 5 chất tan (như kể trên)
(e) Đúng
Câu 39:
Khi phân tích một loại chất béo (kí hiệu là E) chứa đồng thời các triglixerit và axit béo tự do (không có tạp chất khác) xác định được cacbon và oxi lần lượt chiếm 76,74% và 11,31% theo khối lượng. Xà phòng hóa hoàn toàn m gam E bằng dung dịch NaOH (lấy dư 20% so với lượng phản ứng) đun nóng, sau phản ứng thu được dung dịch chứa 0,021 mol NaOH và (m + 1,17) gam hỗn hợp các muối C15H31COONa, C17H31COONa, C17H33COONa, C17H35COONa. Mặt khác, m gam E phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
nNaOH dư = 0,021 → nNaOH phản ứng = 0,105
n chất béo = u và n axit béo = v → 3u + v = 0,105
Bảo toàn khối lượng:
m + 0,105.40 = m + 1,17 + 92u + 18v
→ u = 0,03; v = 0,015
nO(E) = 2nNaOH phản ứng = 0,21
→ m = 0,21.16/11,31% = 29,71
nCO2 = nC = 76,74%.29,71/12 = 1,9
→ nH2O = nH/2 = (mE – mC – mO)/2 = 1,775
n chất béo = u = [nCO2 – (nH2O + nBr2)]/2
→ nBr2 = 0,065
Câu 40:
Hỗn hợp E gồm axit cacboxylic đơn chức X (phân tử có 3 liên kết π), ancol no đa chức Y với tỉ lệ mol tương ứng là 3 : 2. Este hóa hỗn hợp E thu được 3,2 mol hỗn hợp F gồm các chất hữu cơ mạch hở. Thực hiện các thí nghiệm sau:
• Thí nghiệm 1: Cho 0,8 mol F vào bình Na dư thu được 0,675 mol H2.
• Thí nghiệm 2: Đốt cháy hoàn toàn 0,8 mol F cần vừa đủ 3,625 mol O2 thu được nCO2 - nH2O = 1,45.
Trong F có hợp chất hữu cơ Z (phân tử có 22 nguyên tử) chiếm 20% số mol gốc este. Phần trăm khối lượng của Z trong E là
 Xem đáp án
Xem đáp án
Phản ứng: E [X (3x mol) + Y (2x mol)] → F (0,8 mol) + H2O (y mol)
Phản ứng este hóa không làm thay đổi tổng số mol nên:
3x + 2x = 0,8 + y
Cứ 1 mol H2O được tạo ra thì H linh động trong chất hữu cơ bị giảm 2 mol nên:
nH = 3x + 2xr – 2y = 0,675.2
Trong đó r ≥ 2 là số chức của Y.
r = 2 → Vô nghiệm
r = 3 → x = 0,25; y = 0,45
r ≥ 4 → Vô nghiệm
Quy đổi E thành C2HCOOH (0,75), C3H5(OH)3 (0,5) và CH2 (z)
Đốt E cần nO2 = 0,75.2,5 + 0,5.3,5 + 1,5z = 3,625
→ z = 0
Bảo toàn khối lượng → mF = mE – mH2O = 90,4
Z dạng (C2HCOO)kC3H5(OH)3-k
Tổng số nguyên tử = 6k + 8 + 6 – 2k = 22 → k = 2
Z là (C2HCOO)2C3H5(OH)
nCOO (este) = nH2O = 0,45 → nZ = 0,45.20%/2 = 0,045
→ %Z = 9,76%
