(2023) Đề thi thử Hóa THPT Hàn Thuyên, Bắc Ninh (Lần 1) có đáp án
(2023) Đề thi thử Hóa THPT Hàn Thuyên, Bắc Ninh (Lần 1) có đáp án
-
1326 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Cho 11,84 gam hỗn hợp gồm Fe và Cu vào dung dịch H2SO4 loãng dư, thu được 2,688 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị m là
 Xem đáp án
Xem đáp án
Fe + H2SO4 —> FeSO4 + H2
Cu không phản ứng với H2SO4 loãng —> nFeSO4 = nH2 = 0,12
—> mFeSO4 = 18,24 gam
Chọn C
Câu 2:
Khối lượng Ag thu được khi cho 0,1 mol CH3CHO phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, đun nóng là
 Xem đáp án
Xem đáp án
CH3CHO + 2AgNO3 + 3NH3 + H2O —> CH3COONH4 + 2Ag + 2NH4NO3
nAg = 2nCH3CHO = 0,2 —> mAg = 21,6 gam
Chọn C
Câu 3:
X, Y, Z là các hợp chất mạch hở, bền có cùng công thức phân tử C3H6O. X tác dụng được với Na và không có phản ứng tráng bạc. Y không tác dụng được với Na nhưng có phản ứng tráng bạc. Z không tác dụng được với Na và không có phản ứng tráng bạc. Các chất X, Y, Z lần lượt là:
 Xem đáp án
Xem đáp án
X + Na và không tráng gương —> X là ancol CH2=CH-CH2OH
Y không phản ứng với Na nhưng có tráng gương —> Y là andehit C2H5-CHO.
Z không phản ứng với Na và không tráng gương —> Z là xeton CH3-CO-CH3
Chọn A
Câu 4:
Có phương trình hóa học sau: Fe + CuSO4 → Cu + FeSO4. Phương trình nào dưới đây biểu thị sự oxi hóa cho phản ứng hóa học trên?
 Xem đáp án
Xem đáp án
Trong phản ứng trên, Fe bị oxi hóa từ mức 0 lên mức +2:
Fe → Fe2+ + 2e.
Chọn C
Câu 5:
Dung dịch phenol (C6H5OH) không phản ứng được với chất nào sau đây?
 Xem đáp án
Xem đáp án
A. C6H5OH + Na —> C6H5ONa + H2
B. Không phản ứng
C. C6H5OH + NaOH —> C6H5ONa + H2O
D. C6H5OH + Br2 —> C6H2Br3OH↓ + HBr
Chọn B
Câu 6:
Ancol nào sau đây có số nguyên tử cacbon bằng số nhóm -OH?
 Xem đáp án
Xem đáp án
Câu 7:
Trong phân tử propen có số liên kết xich ma (δ) là
 Xem đáp án
Xem đáp án
C3H6 có 6 liên kết δ giữa C-H và 2 liên kết δ giữa C-C
—> Tổng 8 liên kết δ.
Chọn A
Câu 8:
Cho 3,6 gam Mg tác dụng hết với dung dịch HNO3 (dư), sinh ra 2,24 lít khí X (sản phẩm khử duy nhất, ở đktc). Khí X là
 Xem đáp án
Xem đáp án
nMg = 0,15; nX = 0,1
Để tạo 1 mol X cần k mol electron. Bảo toàn electron:
0,15.2 = 0,1k —> k = 3 —> X là NO
Chọn D
Câu 9:
Cho 2 mol axit H3PO4 tác dụng với dung dịch chứa 5 mol NaOH thì sau phản ứng thu được muối nào:
 Xem đáp án
Xem đáp án
nNaOH/nH3PO4 = 2,5 —> Tạo muối Na2HPO4 và Na3PO4
Chọn B
Câu 10:
Cho 50 ml dung dịch HNO3 1M vào 100 ml dung dịch KOH nồng độ x mol/l, sau phản ứng thu được dung dịch chỉ chứa một chất tan duy nhất. Giá trị của x là
 Xem đáp án
Xem đáp án
Chất tan duy nhất là KNO3 —> Phản ứng xảy ra vừa đủ
—> nKOH = nHNO3 —> x = 0,5M
Chọn A
Câu 11:
Sản phẩm chủ yếu trong hỗn hợp thu được khi cho toluen phản ứng với brom theo tỉ lệ số mol 1:1 (có mặt bột sắt) là
 Xem đáp án
Xem đáp án
Toluen C6H5-CH3 có nhóm -CH3 hoạt hóa vòng thơm và định hướng o, p nên sản phẩm là o-bromtoluen và p-bromtoluen.
Chọn D
Câu 12:
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng:
(a) bông khô. (b) bông có tẩm nước.
(c) bông có tẩm nước vôi. (d) bông có tẩm giấm ăn.
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là
 Xem đáp án
Xem đáp án
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là bông có tẩm nước vôi vì:
NO2 + Ca(OH)2 —> Ca(NO3)2 + Ca(NO2)2 + H2O
Chọn B
Câu 13:
Hòa tan hoàn toàn 0,1 gam NaOH vào nước thu được 250ml dung dịch có pH là
 Xem đáp án
Xem đáp án
nOH- = nNaOH = 0,1/40 = 0,0025
—> [OH-] = 0,0025/0,25 = 0,01 —> pH = 12
Chọn D
Câu 14:
Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Chỉ có CuO bị khử:
CuO + CO —> Cu + CO2
nCuO = nO = (9,1 – 8,3)/16 = 0,05
—> mCuO = 4 gam
Chọn D
Câu 15:
Phản ứng hóa học sau: 2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O có phương trình ion rút gọn là
 Xem đáp án
Xem đáp án
Phương trình ion:
2H+ + 2NO3- + Ba2+ + 2OH- —> Ba2+ + 2NO3- + 2H2O
Rút gọn: H+ + OH- → H2O.
Chọn A
Câu 16:
Chất khí nào sau đây được tạo ra từ bình chữa cháy và dùng để sản xuất thuốc giảm đau dạ dày?
 Xem đáp án
Xem đáp án
Khí CO2 được tạo ra từ bình chữa cháy (do CO2 không cháy và không duy trì sự cháy). CO2 còn được dùng sản xuất thuốc giảm đau dạ dày NaHCO3.
Chọn D
Câu 17:
Cho 10,0 ml dung dịch NaOH 0,1M vào cốc đựng 15,0 ml dung dịch HCl 0,1M. Dung dịch tạo thành sẽ làm cho
 Xem đáp án
Xem đáp án
NaOH + HCl —> NaCl + H2O
nNaOH < nHCl nên sau phản ứng dung dịch chứa HCl dư —> Dung dịch tạo thành sẽ làm cho giấy quỳ tím hóa đỏ.
Chọn B
Câu 18:
Trong phương trình phản ứng H2SO4 + P → H3PO4 + SO2 + H2O. Hệ số tối giản của P là:
 Xem đáp án
Xem đáp án
5H2SO4 + 2P → 2H3PO4 + 5SO2 + 2H2O
—> Hệ số tối giản của P là 2.
Chọn C
Câu 20:
Hoà tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 6,72 lít khí thoát ra (ở đktc) và dung dịch X. Cô cạn dung dịch X được bao nhiêu gam muối khan?
 Xem đáp án
Xem đáp án
nH2 = 0,3 —> nCl-(muối) = 0,6
m muối = m kim loại + mCl- = 36,7 gam
Chọn B
Câu 21:
Thực hiện phản ứng sau trong bình kín: H2 (khí) + Br2 (khí) → 2HBr (khí). Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là
 Xem đáp án
Xem đáp án
v = ΔC/Δt = (0,072 – 0,048)/120 = 2.10-4 mol/(l.s)
Chọn B
Câu 22:
Tên thay thế (theo IUPAC) của (CH3)3C–CH2–CH(CH3)2 là
 Xem đáp án
Xem đáp án
(CH3)3C–CH2–CH(CH3)2: 2,2,4-trimetylpentan.
Chọn D
Câu 23:
Dung dịch X có chứa 0,04 mol Na+; 0,1 mol Mg2+; x mol SO42-; y mol Cl-. Làm khô dung dịch X thu được 12,34 gam cặn rắn khan. Giá trị của x và y lần lượt là
 Xem đáp án
Xem đáp án
Bảo toàn điện tích: 0,04 + 0,1.2 = 2x + y
m rắn = 0,04.23 + 0,1.24 + 96x + 35,5y = 12,34
—> x = 0,02; y = 0,2
Chọn B
Câu 24:
Cho m gam hỗn hợp X gồm phenol và etanol phản ứng hoàn toàn với natri (dư), thu được 2,24 lít khí H2 (đktc). Mặt khác, để phản ứng hoàn toàn với m gam X cần 100 ml dung dịch NaOH 1M. Giá trị của m là
 Xem đáp án
Xem đáp án
Với NaOH, chỉ phenol phản ứng:
nC6H5OH = nNaOH = 0,1
Với Na, cả hai chất đều phản ứng:
nH2 = nC6H5OH/2 + nC2H5OH/2 = 0,1
—> nC2H5OH = 0,1
—> mX = 14
Chọn A
Câu 26:
Thêm từ từ từng giọt dung dịch chứa 0,24 mol HCl đồng thời khuấy đều vào 100 ml dung dịch Na2CO3 2M. Thể tích khí CO2 thoát ra (đktc) là
 Xem đáp án
Xem đáp án
H+ + CO32- —> HCO3-
HCO3- + H+ —> CO2 + H2O
—> nH+ = nCO32- + nCO2
—> nCO2 = 0,04
—> V = 0,896 lít
Chọn A
Câu 27:
Trong trường hợp nào sau không dẫn điện được:
 Xem đáp án
Xem đáp án
Một chất dẫn điện khi trong chất đó có các hạt mang điện chuyển động tự do.
A. Dung dịch NaOH: Dẫn điện do có Na+, OH- chuyển động tự do.
B. Nước biển: Dẫn điện do có Na+, Cl-… chuyển động tự do.
C. Nước sông, hồ, ao: Dẫn điện do có Ca2+, Mg2+, HCO3-, Cl-… chuyển động tự do.
D. KCl rắn, khan: Không dẫn điện do K+, Cl- chỉ dao động qua lại quanh vị trí cân bằng, không chuyển động tự do.
Chọn D
Câu 29:
Nguyên tố Bo có 2 đồng vị 10B (x%) và 11B (y%). Nguyên tử khối trung bình của Bo là 10,81 đvC (hay 10,81u). Giá trị của x% là
 Xem đáp án
Xem đáp án
Ta có: x + y = 100
và (10x + 11y)/100 = 10,81
—> x = 19, y = 81
Chọn D
Câu 30:
Khi đun nóng hỗn hợp ancol gồm CH3OH và C2H5OH (xúc tác H2SO4 đặc, ở 140°C) thì số ete thu được tối đa là
 Xem đáp án
Xem đáp án
Khi đun nóng hỗn hợp ancol gồm CH3OH và C2H5OH (xúc tác H2SO4 đặc, ở 140°C) thì số ete thu được tối đa là 3 chất, gồm:
CH3-O-CH3
CH3-O-C2H5
C2H5-O-C2H5
Chọn D
Câu 31:
Đốt cháy hoàn toàn 0,1 mol một axit cacboxylic đơn chức, cần vừa đủ V lít O2 (ở đktc), thu được 0,3 mol CO2 và 0,2 mol H2O. Giá trị của V là
 Xem đáp án
Xem đáp án
Bảo toàn O:
2nAxit + 2nO2 = 2nCO2 + nH2O
—> nO2 = 0,3
—> V = 6,72 lít
Chọn C
Câu 32:
Cho dãy các chất: etan, etanol, etanal, axit etanoic. Chất có nhiệt độ sôi cao nhất trong dãy là
 Xem đáp án
Xem đáp án
Chất có nhiệt độ sôi cao nhất trong dãy là axit etanoic do axit này có phân tử khối lớn nhất và liên kết H liên phân tử bền vững nhất.
Chọn A
Câu 33:
Oxi hoá không hoàn toàn ancol isopropylic bằng CuO nung nóng, thu được chất hữu cơ X. Tên gọi của X là
 Xem đáp án
Xem đáp án
CH3-CHOH-CH3 + CuO —> CH3-CO-CH3 + Cu + H2O
—> X là đimetyl xeton.
Chọn B
Câu 34:
Ngô là loại cây trồng “phàm ăn”, để đảm bảo độ dinh dưỡng trong đất, với mỗi hecta đất trồng ngô, người nông dân cần cung cấp 150 kg N; 60 kg P2O5 và 110 kg K2O. Loại phân mà người nông dân sử dụng là phân hỗn hợp NPK (20 – 20 – 15) trộn với phân kali KCl (độ dinh dưỡng 60%) và ure (độ dinh dưỡng 46%). Tổng khối lượng phân bón đã sử dụng cho 1 hecta đất gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
m phân hỗn hợp = a kg
m phân kali = b kg
m phân urê = c kg
mN = 20%a + 46%c = 150
mP2O5 = 20%a = 60
mK2O = 15%a + 60%b = 110
—> a = 300; b = 325/3; c = 4500/23
—> a + b + c = 604 kg
Chọn D
Câu 35:
Cho 3,5a gam hỗn hợp X gồm C và S tác dụng với lượng dư dung dịch HNO3 đặc, nóng, thu được hỗn hợp Y gồm NO2 và CO2 có thể tích 3,584 lít (đktc). Dẫn toàn bộ Y qua bình đựng dung dịch nước vôi trong dư thu được 12,5a gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a
 Xem đáp án
Xem đáp án
nC = x, nS = y —> 12x + 32y = 3,5a (1)
– Bảo toàn C : nCO2 = x —> nNO2 = 0,16 – x
– Bảo toàn electron : 4x + 6y = 0,16 – x (2)
nCaCO3 = nCO2 = x —> 100x = 12,5a (3)
Tổ hợp giải (1),(2),(3) —> x = 0,02; y = 0,01; a = 0,16.
Chọn B
Câu 36:
Cho sơ đồ chuyển hoá sau:
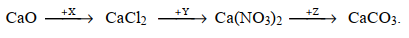
Công thức của X, Y, Z lần lượt là:
 Xem đáp án
Xem đáp án
Công thức của X, Y, Z lần lượt là: HCl, AgNO3, (NH4)2CO3.
CaO + 2HCl —> CaCl2 + H2O
CaCl2 + 2AgNO3 —> Ca(NO3)2 + 2AgCl
Ca(NO3)2 + (NH4)2CO3 —> CaCO3 + 2NH4NO3
Chọn C
Câu 37:
Trung hòa 10,4 gam axit cacboxylic X bằng dung dịch NaOH, thu được 14,8 gam muối. Công thức của X là
 Xem đáp án
Xem đáp án
nNaOH = nH2O = x
Bảo toàn khối lượng:
10,4 + 40x = 14,8 + 18x —> x = 0,2
X dạng R(COOH)n (0,2/n mol)
—> MX = R + 45n = 10,4n/0,2
—> R = 7n
—> n = 2; R = 14: -CH2-
X là HOOC-CH2-COOH
Chọn C
Câu 38:
X, Y, Z là ba hiđrocacbon mạch hở (MX < MY < MZ < 62) có cùng số nguyên tử cacbon trong phân tử và đều phản ứng với dung dịch AgNO3 trong NH3 dư. Cho 11,7 gam hỗn hợp E gồm X, Y, Z (có cùng số mol) tác dụng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
Các chất X, Y, Z thỏa mãn là:
X là CH≡C-C≡CH
Y là CH≡C-CH=CH2
Z là CH≡C-CH2-CH3
nX = nY = nZ = e
—> mE = 50e + 52e + 54e = 11,7
—> e = 0,075
nBr2 = 4nX + 3nY + 2nZ = 0,675
Chọn A
Câu 39:
Hỗn hợp khí và hơi X gồm etilen, anđehit axetic, ancol anlylic và axit axetic. Trộn X với V lít H2 (đktc) rồi cho qua Ni nung nóng, thu được hỗn hợp Y (gồm khí và hơi). Đốt cháy hoàn toàn Y thu được 0,15 mol CO2 và 0,2 mol H2O. Giá trị của V là
 Xem đáp án
Xem đáp án
Các chất trong X khi cháy đều tạo nH2O = nCO2 = 0,15
Bảo toàn H —> nH2 = 0,2 – 0,15 = 0,05
—> V = 1,12 lít
Chọn C
Câu 40:
Hỗn hợp X gồm axit axetic, propan-2-ol. Cho một lượng X phản ứng vừa đủ với Na, thu được 0,448 lít khí H2 (đktc) và m gam chất rắn Y. Giá trị của m là
 Xem đáp án
Xem đáp án
CH3COOH + Na —> CH3COONa + 0,5H2
C3H7OH + Na —> C3H7ONa + 0,5H2
nH2 = 0,02 —> nY = nX = 0,04
Các muối có cùng M = 82 nên mY = 0,04.82 = 3,28
Chọn A
