(2023) Đề thi thử Hóa THPT Hồng Lĩnh, Hà Tĩnh (Lần 1) có đáp án
(2023) Đề thi thử Hóa THPT Hồng Lĩnh, Hà Tĩnh (Lần 1) có đáp án
-
421 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 4:
Trong y tế, khí X được hóa lỏng dùng để làm chất duy trì hô hấp cho bệnh nhân. Khí X đó là
 Xem đáp án
Xem đáp án
Chọn D
Câu 10:
Nhiều vụ ngộ độc rượu do trong rượu có chứa metanol. Công thức của metanol là
 Xem đáp án
Xem đáp án
Chọn A
Câu 11:
Chất X là một khí rất độc, có trong thành phần của khí than than khô (khoảng 25%). Chất X là
 Xem đáp án
Xem đáp án
Chọn D
Câu 15:
Thủy phân este nào sau đây trong môi trường kiềm tạo ra 2 sản phẩm hữu cơ có cùng số nguyên tử cacbon?
 Xem đáp án
Xem đáp án
CH3COOC2H5 + NaOH —> CH3COONa + C2H5OH
Hai sản phẩm có cùng 2C.
Chọn D
Câu 16:
Dùng thí nghiệm nào sau đây để phân biệt C2H2 và C2H4?
 Xem đáp án
Xem đáp án
Dùng phản ứng với dung dịch AgNO3/NH3 để phân biệt C2H2 và C2H4: Chỉ C2H2 phản ứng tạo kết tủa màu vàng:
C2H2 + AgNO3 + NH3 —> C2Ag2↓ + NH4NO3
Chọn B
Câu 17:
Cho kim loại R vào dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được dung dịch A và chất rắn X. Chất rắn X có khả năng tan hoàn toàn trong dung dịch H2SO4 loãng dư. R là kim loại nào sau đây?
 Xem đáp án
Xem đáp án
X có khả năng tan hoàn toàn trong dung dịch H2SO4 loãng dư nên X không chứa Cu
—> R là Na và X là Cu(OH)2:
Na + H2O —> NaOH + H2
NaOH + CuSO4 —> Cu(OH)2 + Na2SO4
Cu(OH)2 + H2SO4 —> CuSO4 + H2O
Chọn B
Câu 18:
Cho 0,15 mol Gly-Glu tác dụng với dung dịch KOH dư, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, số mol KOH đã phản ứng là
 Xem đáp án
Xem đáp án
Gly-Glu + 3KOH —> GlyK + GluK2 + 2H2O
0,15………….0,45
Chọn D
Câu 20:
Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có
 Xem đáp án
Xem đáp án
Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có kết tủa trắng xuất hiện:
Ca(OH)2 + Ca(HCO3)2 —> 2CaCO3 + 2H2O
Chọn B
Câu 21:
Cho 12,6 gam hỗn hợp Mg và Al tác dụng với dung dịch H2SO4 (dư), thu được 70,2 gam hỗn hợp muối và V lít khí H2. Giá trị của V là
 Xem đáp án
Xem đáp án
nH2 = nSO42- = (m muối – m kim loại)/96 = 0,6
—> VH2 = 13,44 lít
Chọn D
Câu 22:
Một loại nước cứng khi được đun sôi thì mất tính cứng. Trong loại nước cứng này có hoà tan những hợp chất nào sau đây?
 Xem đáp án
Xem đáp án
Một loại nước cứng khi đun sôi thì mất tính cứng —> Đây là nước cứng tạm thời, chứa Ca(HCO3)2, Mg(HCO3)2
Ca(HCO3)2 —> CaCO3 + CO2 + H2O
Mg(HCO3)2 —> MgCO3 + CO2 + H2O
Chọn A
Câu 23:
Cho các polime sau đây: (1) tơ tằm; (2) sợi bông; (3) sợi đay; (4) tơ enang; (5) tơ visco; (6) nilon-6,6; (7) tơ axetat. Số polime có nguồn gốc xenlulozơ là
 Xem đáp án
Xem đáp án
Các polime có nguồn gốc xenlulozơ: (2), (3), (5), (7)
Chọn B
Câu 24:
 Xem đáp án
Xem đáp án
C12H22O11 —> 2C6H12O6 —> 4Ag
342…………………………..4.108
62,5.17,1%………………….mAg
—> mAg = 62,5.17,1%.4.108/342 = 13,5
Chọn A
Câu 25:
Cho 13,6 gam CH3COOC6H5 tác dụng với 300 ml dung dịch NaOH 1M, sau phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thì khối lượng chất rắn thu được là
 Xem đáp án
Xem đáp án
CH3COOC6H5 + 2NaOH —> CH3COONa + C6H5ONa + H2O
nCH3COOC6H5 = 0,1; nNaOH = 0,3 —> nH2O = 0,1
Bảo toàn khối lượng —> m rắn = 23,8 gam
Chọn C
Câu 26:
Nhận định nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Sai, triolein (C17H33COO)3C3H5 có 6 liên kết π (3C=C và 3C=O)
B. Đúng, tính axit ở nhóm -COOH, tính bazơ ở nhóm -NH2.
C. Đúng: Glu-Ala-Gly + 4NaOH —> GluNa2 + AlaNa + GlyNa + 2H2O
D. Đúng, saccarozơ có nhiều OH kề nhau nên có tính chất của ancol đa chức.
Chọn A
Câu 27:
Chất X là thành phần chính tạo nên màng tế bào thực vật, tạo nên bộ khung của cây cối. Thủy phân hoàn toàn X, thu được chất Y. Trong mật ong Y chiếm khoảng 30%. Trong máu người có một lượng nhỏ Y không đổi là 0,1%. Hai chất X, Y lần lượt là
 Xem đáp án
Xem đáp án
Chất X là thành phần chính tạo nên màng tế bào thực vật, tạo nên bộ khung của cây cối —> X là xenlulozơ.
Thủy phân hoàn toàn X, thu được chất Y —> Y là glucozơ.
Chọn A
Câu 28:
Phát biểu nào sau đây là sai?
 Xem đáp án
Xem đáp án
A. Đúng, cặp điện cực Fe-C đặt trong môi trường điện li là không khí ẩm nên có ăn mòn điện hóa.
B. Đúng: CaCO3 + CH3COOH —> (CH3COO)2Ca + CO2 + H2O
C. Đúng, do CO32- tạo kết tủa với Ca2+, Mg2+:
Ca2+ + CO32- —> CaCO3;
Mg2+ + CO32- —> MgCO3
D. Sai, thạch cao nung là CaSO4.H2O.
Chọn D
Câu 29:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Đúng, vì các vật liệu này đều có -CONH- dễ bị thủy phân trong kiềm.
B. Đúng
C. Sai, trùng ngưng axit p-phtalic và etylen glicol để được tơ lapsan.
D. Đúng
Chọn C
Câu 30:
Cho 21,4 gam hỗn hợp A gồm Al và Fe2O3 tác dụng hết với dung dịch HCl dư được dung dịch C. Cho C tác dụng với dung dịch NaOH dư được kết tủa D. Nung D trong không khí đến khối lượng không đổi thu được 16 gam chất rắn. Khối lượng Al và Fe2O3 trong hỗn hợp A lần lượt là:.
 Xem đáp án
Xem đáp án
NaOH dư hòa tan hết Al(OH)3 nên mFe2O3 = 16 gam
—> mAl = mA – mFe2O3 = 5,4
Chọn A
Câu 31:
Thực hiện các thí nghiệm sau:
(1) Cho dung dịch Ca(OH)2 dư vào dung dịch Mg(HCO3)2.
(2) Cho dung dịch FeCl2 vào dung dịch AgNO3 (dư).
(3) Cho 2x mol Ba vào dung dịch chứa x mol Al2(SO4)3.
(4) Cho từ từ đến dư dung dịch NaOH vào dung dịch chứa AlCl3 và CuCl2.
(5) Cho dung dịch chưa 4a mol Ba(OH)2 vào dung dịch chưa 3a mol H3PO4 và đun nóng.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa gồm hai chất là
 Xem đáp án
Xem đáp án
(1) 2Ca(OH)2 + Mg(HCO3)2 —> CaCO3 + Mg(OH)2 + 2H2O
(2) FeCl2 + 3AgNO3 —> Fe(NO3)3 + 2AgCl + Ag
(3) Ba + 2H2O —> Ba(OH)2 + H2
3Ba(OH)2 + Al2(SO4)3 —> 3BaSO4 + 2Al(OH)3
Al2(SO4)3 còn dư.
(4) AlCl3 + 4NaOH —> NaAlO2 + 3NaCl + 2H2O
CuCl2 + 2NaOH —> Cu(OH)2 + 2NaCl
(5) Tỉ lệ nH+/nOH- = 9a/8a —> Tạo Ba3(PO4)2 và BaHPO4
Chọn D
Câu 32:
Cho sơ đồ chuyển hóa:
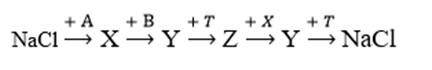
Biết A, B, X, Y, Z, T là các hợp chất khác nhau; X, Y, Z có chứa natri; MX + MZ = 96; mỗi mũi tên ứng với một phương trình hóa học của phản ứng xảy ra giữa 2 chất tương ứng các điều kiện phản ứng coi như có đủ. Phân tử khối của chất nào sau đây đúng?
 Xem đáp án
Xem đáp án
A là H2O; X là NaOH
MX + MZ = 96 —> MZ = 56: Z là NaHS
B là (NH4)2S
Y là Na2S —> C đúng
T là HCl
Các phản ứng:
NaCl + H2O (điện phân có màng ngăn) —> NaOH + Cl2 + H2
NaOH + (NH4)2S —> Na2S + NH3 + H2O
Na2S + HCl —> NaHS + NaCl
NaHS + NaOH —> Na2S + H2O
Na2S + HCl —> NaCl + H2S
Chọn C
Câu 33:
Thực hiện các sơ đồ phản ứng sau:
(a) X1 + X2 dư → X3 + X4↓ + H2O.
(b) X1 + X3 → X5 + H2O.
(c) X2 + X5 → X4 + 2X3.
(d) X4 + X6 → BaSO4 + CO2 + H2O.
Biết các chất phản ứng theo đúng tỉ lệ mol. Các chất X2 và X6 thỏa mãn sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
(d) —> X4 là BaCO3 và X6 là H2SO4 (do X4 không tan, theo phản ứng (a)).
(a) X1 + X2 dư → X3 + X4↓ + H2O.
KOH + Ba(HCO3)2 dư → KHCO3 + BaCO3 + H2O
(b) X1 + X3 → X5 + H2O.
KOH + KHCO3 → K2CO3 + H2O
(c) X2 + X5 → X4 + 2X3.
Ba(HCO3)2 + K2CO3 → BaCO3 + 2KHCO3
(d) X4 + X6 → BaSO4 + CO2 + H2O.
BaCO3 + H2SO4 → BaSO4 + CO2 + H2O
—> X2 là Ba(HCO3)2 và X6 là H2SO4.
Chọn B
Câu 34:
Cho sơ đồ phản ứng (theo đúng tỉ lệ mol):
(1) E + NaOH → X + Y
(2) F + 3NaOH → X + Y + 2Z
(3) 2X + H2SO4 → 2T + Na2SO4
Biết E, F là những este no, mạch hở công thức phân tử có dạng CnHmOn (E, F chỉ chứa nhóm chức este trong phân tử). Cho các phát biểu sau:
(a) Hai chất E và Z có cùng số nguyên tử cacbon.
(b) Chất Z là hợp chất hữu cơ tạp chức.
(c) Từ chất Y có thể điều chế trực tiếp được CH3COOH.
(d) Chất F là este của glixerol với axit caboxylic.
(e) Chất T được sử dụng để điều chế khí CO trong phòng thí nghiệm.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Theo tỉ lệ phản ứng (1)(2) thì E đơn chức, F ba chức
—> E là C2H4O2 (HCOOCH3); X là HCOONa; Y là CH3OH
F là C6H8O6 (HCOO-CH2-COO-CH2-COO-CH3)
Z là HO-CH2-COONa
(a) Đúng
(b) Đúng
(c) Đúng: CH3OH + CO —> CH3COOH
(d) Sai
(e) Đúng: HCOOH (H2SO4 đặc) —> CO + H2O
Chọn D
Câu 35:
Hòa tan m gam hỗn hợp A gồm Mg, Al, MgO, Al2O3 bằng dung dịch HCl vừa đủ thì được dung dịch chứa (m + 70,295) gam muối. Cho m gam hỗn hợp A tác dụng dung dịch H2SO4 đặc nóng dư thu được 13,328 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho m gam hỗn hợp A tác dụng HNO3 loãng dư thu được 3,808 lít hỗn hợp khí NO, N2O có tỉ khối hơi so với H2 là 318/17 và dung dịch Y. Cô cạn dung dịch Y thu được 162,15 gam muối khan. Giá trị của m là
 Xem đáp án
Xem đáp án
nSO2 = 0,595
Bảo toàn electron —> nH2 = 0,595
Đặt nO(A) = x —> nH2O = x
Bảo toàn H —> nHCl = 2x + 1,19
m muối = m – 16x + 35,5(2x + 1,19) = m + 70,295
—> x = 0,51
Với HNO3:
nNO = 0,08 và nN2O = 0,09
Bảo toàn electron —> 0,595.2 = 3nNO + 8nN2O + 8nNH4NO3
—> nNH4NO3 = 0,02875
m muối = (m – 16x) + 62(0,595.2 + 2x) + 80.0,02875 = 162,15
—> m = 30,99
Chọn D
Câu 36:
Chia 19,92 gam hỗn hợp X gồm metan, propilen, isopren thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một, thu được H2O và 31,68 gam CO2. Phần hai trộn với 0,3 mol H2 rồi dẫn qua bột Ni đốt nóng, thu được hỗn hợp Y có tỉ khối so với hiđro là 13,2. Biết Y làm mất màu tối đa m gam Br2 trong dung dịch. Giá trị của m là
 Xem đáp án
Xem đáp án
Mỗi phần nặng 9,96 gam
X gồm CH4, C3H6, C5H8 —> Có dạng CxHx+3
nCO2 = 0,72 —> nX = 0,72/x
—> MX = 13x + 3 = 9,96x/0,72 —> x = 3,6
—> nX = 0,2
mY = mX + mH2 = 10,56 —> nY = 0,4
—> nH2 phản ứng = (nX + nH2) – nY = 0,1
Bảo toàn liên kết pi: 0,2(2x + 2 – x – 3)/2 = nH2 phản ứng + nBr2
—> nBr2 = 0,16 —> mBr2 = 25,6
Chọn A
Câu 37:
Hỗn hợp E chứa triglixerit X và este Y đa chức mạch hở. Thủy phân m gam E trong dung dịch KOH vừa đủ thu được một ancol và 11,39 gam hỗn hợp ba muối kali của axit oleic và 2 axit cacboxylic thuộc dãy đồng đẳng của axit acrylic. Đốt cháy 11,39 gam hỗn hợp muối này thu được 9,495 gam nước. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Quy đổi muối thành C2H3COOK (u) và CH2 (v)
m muối = 110u + 14v = 11,39
nH2O = 1,5u + v = 0,5275
—> u = 0,045; v = 0,46
nC3H5(OH)3 = u/3 = 0,015 và nKOH = u = 0,045
Bảo toàn khối lượng:
mE + mKOH = m muối + mC3H5(OH)3
—> mE = 10,25 gam
Chọn B
Câu 38:
Điện phân (điện cực trơ, màng ngăn xốp) dung dịch X gồm CuSO4 và NaCl với cường độ dòng điện không đổi = 2A. Sau thời gian t giây, thu được dung dịch Y và 0,04 mol hỗn hợp khí ở anot. Mặt khác, nếu điện phân X trong thời gian 2t giây thì thu được dung dịch Z; 0,04 mol khí ở catot và 0,07 mol khí ở anot. Dung dịch Z hòa tan tối đa m gam Mg. Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Giá trị của m là.
 Xem đáp án
Xem đáp án
Trong thời gian t đến 2t tại anot thoát ra nO2 = 0,07 – 0,04 = 0,03
—> ne trong t giây = 0,03.4 = 0,12
Trong t giây đầu tiên, anot có Cl2 (u) và O2 (v)
—> u + v = 0,04 và 2u + 4v = 0,12
—> u = v = 0,02
Sau 2t giây, bảo toàn electron cho catot:
2nCu + 2nH2 = 0,12.2 —> nCu = 0,08
Ban đầu: nCuSO4 = 0,08; nNaCl = 2u = 0,04
Z + Mg —> Dung dịch chứa Na+ (0,04), SO42- (0,08), bảo toàn điện tích —> nMg2+ = 0,06
—> mMg = 0,06.24 = 1,44
Chọn A
Câu 39:
Hỗn hợp X chứa ba este đều mạch hở và không chứa nhóm chức khác; trong mỗi phân tử este đều có số liên kết π không quá 5. Đun nóng m gam X cần dùng 800 ml dung dịch NaOH 1M, thu được hỗn hợp Y gồm các ancol đơn chức thuộc cùng dãy đồng đẳng và (0,75m + 12,56) gam hỗn hợp Z gồm hai muối của hai axit cacboxylic có mạch không phân nhánh, trong đó có a gam muối T và b gam muối E (MT < ME). Nung nóng Z với vôi tôi xút (dùng dư) thu được hỗn hợp khí nặng 6,8 gam. Mặt khác, đốt cháy hoàn toàn m gam X cần dùng 2,92 mol O2. Giá trị của b là
 Xem đáp án
Xem đáp án
nNaOH = 0,8
Phản ứng vôi tôi xút thay thế COONa bằng H nên:
m muối = 6,8 + 0,8(67 – 1) = 0,75m + 12,56
—> m = 62,72
Bảo toàn khối lượng —> mAncol = 35,12
—> M ancol = 43,9 —> Có CH3OH —> Ancol dạng CnH2n+1OH với n = 1,85
Quy đổi muối thành COONa (0,8), C (u), H (v)
m muối = 0,8.67 + 12u + v = 59,6
nO2 = 0,8.0,25 + u + 0,25v + 0,8.1,5n = 2,92
—> u = 0,5; v = 0
Muối không quá 5π —> (COONa)2 (0,15) và C2(COONa)2 (0,25)
—> mC2(COONa)2 = 39,50 gam
Chọn C
Câu 40:
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Rót khoảng 3ml dung dịch saccarozơ 1% vào ống nghiệm có sẵn 1ml dung dịch H2SO4 10%. Đun nóng dung dịch khoảng 2-3 phút rồi làm lạnh.
Bước 2: Cho từ từ tinh thể NaHCO3 vào ống nghiệm sau bước 1 và khuấy đều cho đến khi ngừng thoát khí.
Bước 3: Nhỏ từ từ dung dịch NH3 loãng vào 2ml dung dịch AgNO3 loảng đến khi kết tủa tan hoàn toàn. Cho toàn bộ phần dung dịch thu được vào ống nghiệm sau bước 2 và ngâm trong cốc nước nóng.
Cho các phát biểu sau:
(a) Tại bước 1 xảy ra phản ứng thủy phân saccarozơ.
(b) NaHCO3 có tác dụng loại bỏ H2SO4 trong ống nghiệm sau bước 1.
(c) Sau bước 3, tại thành ống nghiệm xuất hiện lớp bạc bám vào.
(d) Tại bước 1, có thể thay dung dịch H2SO4 loãng bằng dung dịch HCl 10%.
(e) Tại bước 1, việc làm lạnh dung dịch là không cần thiết.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng: Saccarozơ + H2O —> Glucozơ + Fructozơ
(b) Đúng: NaHCO3 + H2SO4 —> Na2SO4 + CO2 + H2O
(c) Đúng, các sản phẩm glucozơ, fructozơ đều có tráng gương.
(d) Đúng
(e) Sai, nên làm lạnh để bọt khí bước 2 không trào ra quá mạnh. Mặt khác hỗn hợp tham gia phản ứng tráng gương phải ở nhiệt độ thường rồi làm nóng từ từ, nóng quá mạnh ngay từ đầu có thể làm Ag tạo ra bị vón cục.
Chọn C
