(2023) Đề thi thử Hóa THPT Trần Đăng Ninh, Hà Nội (Lần 1) có đáp án
(2023) Đề thi thử Hóa THPT Trần Đăng Ninh, Hà Nội (Lần 1) có đáp án
-
903 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 6:
Khi thuỷ phân chất béo trong môi trường kiềm thì thu được muối của axit béo và
 Xem đáp án
Xem đáp án
Chọn D
Câu 14:
Kim loại nào sau đây có tính dẫn điện tốt nhất trong tất cả các kim loại sau?
 Xem đáp án
Xem đáp án
Chọn B
Câu 20:
Axit amino axetic tác dụng được với dung dịch
 Xem đáp án
Xem đáp án
Axit amino axetic tác dụng được với dung dịch NaOH:
H2NCH2COOH + NaOH —> H2NCH2COONa + H2O
Chọn C
Câu 21:
Trong môi trường kiềm chất nào sau đây tác dụng với Cu(OH)2 cho hợp chất màu tím?
 Xem đáp án
Xem đáp án
Tripeptit trở lên tạo màu tím với Cu(OH)2 —> Chọn Gly-Gly-Ala.
Chọn B
Câu 22:
Cho 17,8 gam amino axit X (phân tử chứa một nhóm -NH2 và một nhóm -COOH) tác dụng vừa đủ với dung dịch NaOH, thu được dung dịch chứa 22,2 gam muối. Số công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
nX = (m muối – mX)/22 = 0,2
—> MX = 89: C3H7NO2
Các cấu tạo của X:
NH2-CH2-CH2-COOH
CH3-CH(NH2)-COOH
Chọn B
Câu 23:
Đốt cháy hoàn toàn m gam saccarozơ cần vừa đủ V lít O2 (đktc), thu được 26,4 gam CO2. Giá trị của V là
 Xem đáp án
Xem đáp án
Quy đổi saccarozơ thành C và H2O
—> nO2 = nCO2 = 0,6
—> VO2 = 13,44 lít
Chọn A
Câu 24:
Khi thủy phân hoàn toàn 65 gam một peptit X thu được 22,25 gam alanin và 56,25 gam glyxin. X là
 Xem đáp án
Xem đáp án
nAla = 0,25; nGly = 0,75 —> Ala : Gly = 1 : 3
Bảo toàn khối lượng —> nH2O = 0,75
[(Ala)(Gly)3]n + (4n – 1)H2O —> nAla + 3nGly
……………………………0,75………….0,25
—> 0,25(4n – 1) = 0,75n —> n = 1
—> X là (Ala)(Gly)3 (Tetrapeptit)
Chọn D
Câu 25:
Cho các chất sau: metyl fomat, axit axetic, ancol etylic, etyl amin. Chất có độ tan trong nước nhỏ nhất là
 Xem đáp án
Xem đáp án
Este có độ tan nhỏ nhất do không tạo liên kết H với H2O —> Chọn metyl fomat.
Chọn D
Câu 26:
Dẫn V lít hỗn hợp khí gồm CO và H2 đi qua lượng dư hỗn hợp Fe2O3, CuO nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn giảm 6,4 gam so với ban đầu. Giá trị của V (đktc) là
 Xem đáp án
Xem đáp án
nCO + nH2 = nO = 6,4/16 = 0,4
—> V = 8,96 lít
Chọn D
Câu 27:
Cho 2,33 gam hỗn hợp Zn và Fe vào một lượng dư dung dịch HCl. Sau phản ứng xảy ra hoàn toàn, thu được 896 ml khí H2 (đktc) và dung dịch Y có chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
nH2 = 0,04 —> nCl- = 0,08
—> m muối = 2,33 + 0,08.35,5 = 5,17
Chọn D
Câu 28:
Từ 32,4 tấn xenlulozơ người ta sản xuất được m tấn xenlulozơ trinitrat (biết hiệu suất phản ứng tính theo xenlulozơ là 90%). Giá trị của m là
 Xem đáp án
Xem đáp án
C6H10O5 —> C6H7O2(NO3)3
162……………………297
32,4……………………m
—> m = 90%.32,4.297/162 = 53,46 tấn
Chọn B
Câu 29:
Không thể dùng dung dịch (trong nước) nào sau đây để phân biệt CO2 và SO2?
 Xem đáp án
Xem đáp án
Không thể dùng dung dịch Ba(OH)2 để phân biệt CO2 và SO2 vì chúng đều tạo kết tủa trắng và kết tủa tan khi các khí dùng dư.
Các chất H2S, KMnO4, Br2 chỉ tác dụng với SO2, không tác dụng với CO2 nên có thể dùng để phân biệt được.
Chọn A
Câu 31:
Cho X, Y là hai axit cacboxylic đơn chức (MX < MY); T là este ba chức, mạch hở được tạo bởi X, Y với glixerol. Cho 23,06 gam hỗn hợp E gồm X, Y, T và glixerol (số mol của X bằng 8 lần số mol của T) tác dụng với dung dịch NaOH 2M thì cần vừa đủ 200 ml, thu được hỗn hợp F gồm hai muối có tỉ lệ mol 1 : 3 và 3,68 gam glixerol. Đốt cháy hoàn toàn F cần vừa đủ 0,45 mol O2, thu được Na2CO3, H2O và 0,4 mol CO2. Phần trăm khối lượng của T trong E có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nNaOH = 0,4 —> nNa2CO3 = 0,2
nO(F) = 2nNaOH = 0,8
Bảo toàn O —> nH2O = 0,3
Muối gồm CnHmO2Na (0,1 mol) và Cn’Hm’O2Na (0,3 mol)
nC = 0,1n + 0,3n’ = nNa2CO3 + nCO2
—> n + 3n’ = 6 —> n = 3 và n’ = 1 là nghiệm duy nhất —> m’ = 1
nH = 0,1m + 0,3m’ = 0,3.2 —> m = 3
Muối gồm CH2=CH-COONa (0,1) và HCOONa (0,3)
Quy đổi E thành:
HCOOH: 0,3 mol
CH2=CH-COOH: 0,1 mol
C3H5(OH)3: 0,04 mol
H2O: -e mol
mE = 23,06 —> e = 0,09
—> nT = e/3 = 0,03
—> nX = 8nT = 0,24
—> nX trong T = 0,3 – 0,24 = 0,06
Dễ thấy nX trong T = 2nT nên phân tử T có 2 gốc X và 1 gốc Y.
T là (HCOO)2(C2H3COO)C3H5 (0,03) —> %T = 26,28%
Chọn B
Câu 32:
Cho hiđrocacbon X mạch hở, là chất khí ở điều kiện thường phản ứng hoàn toàn với H2 dư, (Ni, t°) thu được CH3-CH2-CH2-CH3. Số chất X thỏa mãn điều kiện là
 Xem đáp án
Xem đáp án
CH2=CH-CH2-CH3
CH3-CH=CH-CH3
CH2=CH-CH=CH2
CH2=C=CH-CH3
CH2=C=C=CH2
CH≡C-CH2-CH2
CH3-C≡C-CH3
CH2=CH-C≡CH
CH≡C-C≡CH
X có 10 chất thỏa mãn (bao gồm đồng phân hình học của chất thứ 2)
Chọn A
Câu 33:
Dẫn a mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 1,35a mol hỗn hợp khí Y gồm H2, CO và CO2. Sục hỗn hợp khí Y vào dung dịch Ba(OH)2 kết quả thí nghiệm được biểu diễn theo đồ thị:
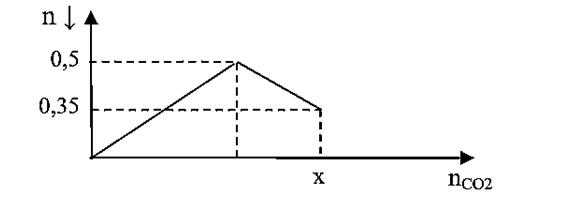
Giá trị của a là
 Xem đáp án
Xem đáp án
Khi nCO2 = x thì nBaCO3 = 0,35 và nBa(HCO3)2 = 0,5 – 0,35 = 0,15
Bảo toàn C —> x = 0,65
nC phản ứng = nY – nX = 0,35a
Bảo toàn electron: 4nC phản ứng = 2nCO + 2nH2
—> nCO + nH2 = 0,7a
—> nCO2 = 0,65 = 1,35a – 0,7a
—> a = 1
Chọn D
Câu 34:
Cho m gam hỗn hợp gồm Mg, Fe và Cu vào 200 ml dung dịch chứa FeCl3 0,8M và CuCl2 0,1M. Sau khi kết thúc phản ứng thu được dung dịch X và 11,84 gam chất rắn Y gồm 2 kim loại. Cho dung dịch AgNO3 dư vào X, thu được 87,58 gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
nFeCl3 = 0,16 và nCuCl2 = 0,02
Y gồm Fe, Cu nên X gồm Mg2+; và Fe2+ và Cl- (0,52)
—> nAgCl = 0,52 —> nAg = 0,12 —> nFe2+ = 0,12
Bảo toàn điện tích cho X —> nMg2+ = 0,14
Bảo toàn khối lượng kim loại:
m + 0,16.56 + 0,02.64 = 0,14.24 + 0,12.56 + 11,84
—> m = 11,68
Chọn A
Câu 35:
Thực hiện các thí nghiệm sau:
(a) Sục khí C2H4 vào ống nghiệm đựng dung dịch brom.
(b) Cho một nhúm bông vào cốc đựng dung dịch H2SO4 70%, đun nóng đồng thời khuấy đều.
(c) Sục khí H2 vào nồi kín chứa triolein (xúc tác Ni), đun nóng.
(d) Nhỏ vài giọt giấm ăn vào ống nghiệm đựng dung dịch etylamin.
(e) Nhỏ vài giọt dung dịch NaOH vào ống nghiệm đựng dung dịch lysin.
(g) Nhỏ vài giọt dung dịch axit fomic vào ống nghiệm dựng dung dịch AgNO3 trong NH3, đun nóng.
Số thí nghiệm xảy ra phản ứng hóa học là
 Xem đáp án
Xem đáp án
Tất cả đều có phản ứng:
(a) C2H4 + Br2 —> C2H4Br2
(b) (C6H10O5)n + nH2O —> nC6H12O6
(c) (C17H33COO)3C3H5 + 3H2 —> (C17H35COO)3C3H5
(d) CH3COOH + C2H5NH2 —> CH3COONH3-C2H5
(e) Lys + NaOH —> LysNa + H2O
(g) HCOOH + AgNO3 + NH3 + H2O —> (NH4)2CO3 + NH4NO3 + Ag
Chọn B
Câu 36:
Biết hợp chất X có công thức phân tử là C11H10O4 và các phản ứng dưới đây xảy ra theo đúng tỉ lệ mol:
X + 3NaOH (t°) → X1 + X2 + X3 + H2O
X2 + 2AgNO3 + 3NH3 + H2O (t°) → X4 + 2Ag + 2NH4NO3
X4 + NaOH (t°) → X1 + NH3 + H2O
Trong số các phát biểu sau, có mấy phát biểu đúng?
(a) X có 3 đồng phân và có khả năng phản ứng với dung dịch brom.
(b) X3 tác dụng với dung dịch axit clohiđric theo tỉ lệ mol tương ứng là 1:2.
(c) X1, X2 có cùng số nguyên tử cacbon.
(d) Đốt cháy hoàn toàn X3, thu được khối lượng CO2 lớn hơn 2 lần khối lượng Na2CO3.
(e) Số liên kết π trong phân tử X3 là 5.
 Xem đáp án
Xem đáp án
Từ X tạo 3 sản phẩm X1, X2, X3 nên X phải có 2 chức este.
X có 4 oxi nhưng tác dụng với NaOH theo tỉ lệ 1 : 3 nên X có chức este của phenol.
Hai phản ứng cuối —> X1, X2, X4 cùng C và ít nhất 2C, trong đó X2 là anđehit và X1 là muối cacboxylat.
X là:
CH3COO-C6H4-COO-CH=CH2 (o, m, p)
X1 là CH3COONa
X2 là CH3CHO
X3 là NaOC6H4COONa
X4 là CH3COONH4
(a) Đúng, X có 3 đồng phân o, m, p và đều tác dụng với Br2 do có C=C
(b) Đúng: X3 + 2HCl —> HO-C6H4-COOH + 2NaCl
(c) Đúng
(d) Đúng:
NaOC6H4COONa + 7O2 —> Na2CO3 + 6CO2 + 2H2O
mCO2 = 44.6 > 2mNa2CO3 = 2.106
(e) Sai, X3 có 4π, gồm 3C=C và 1C=O
Chọn B
Câu 37:
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Lấy vào ống nghiệm thứ nhất 0,5 ml dung dịch HNO3 đặc (68%) và ống nghiệm thứ hai 0,5 ml dung dịch HNO3 15%.
Bước 2: Cho vào mỗi ống nghiệm một mảnh nhỏ đồng kim loại. Nút các ống nghiệm bằng bông tẩm dung dịch NaOH. Đun nhẹ ống nghiệm thứ hai.
Cho các phát biểu sau:
(1) Ở hai ống nghiệm, mảnh đồng tan dần, dung dịch chuyển sang màu xanh.
(2) Ở ống nghiệm thứ nhất, có khí màu nâu đỏ thoát ra khỏi dung dịch.
(3) Ở ống nghiệm thứ hai, thấy có khí không màu, không hóa nâu thoát ra khỏi dung dịch.
(4) Bông tẩm dung dịch NaOH có tác dụng hạn chế khí độc NO2 thoát ra khỏi ống nghiệm.
(5) Có thể thay bông tẩm dung dịch NaOH bằng bông tẩm dung dịch NaCl.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(1) Đúng, Cu phản ứng được với cả HNO3 đặc và loãng.
(2) Đúng:
Cu + HNO3 đặc —> Cu(NO3)2 + NO2 + H2O
(3) Sai, ống 2 thoát khí không màu bị hóa nâu:
Cu + HNO3 loãng —> Cu(NO3)2 + NO + H2O
(4) Đúng:
NO2 + NaOH —> NaNO3 + NaNO2 + H2O
(5) Sai, NaCl không ngăn được NO2.
Chọn B
Câu 38:
Cho este đa chức X (có công thức phân tử C5H8O4) tác dụng với dung dịch NaOH, thu được sản phẩm gồm một muối của axit cacboxylic Y và một ancol Z. Biết Z tác dụng với Cu(OH)2 tạo dung dịch màu xanh lam. Số công thức cấu tạo phù hợp với tính chất của X là
 Xem đáp án
Xem đáp án
X + NaOH —> 1 muối + 1 ancol có 2OH kề nhau
—> Cấu tạo của X là:
HCOO-CH2-CH(CH3)-OOCH
Chọn D
Câu 39:
Hỗn hợp E gồm chất X (CmH2m+4O4N2) và chất Y (CnH2n+3O2N). Đốt cháy hoàn toàn 0,2 mol E cần dùng vừa đủ 0,58 mol O2, thu được N2, CO2 và 0,84 mol H2O. Mặt khác, cho 0,2 mol E tác dụng hết với dung dịch NaOH, cô cạn dung dịch sau phản ứng, thu được một chất khí duy nhất làm xanh quỳ tím ẩm và a gam hỗn hợp hai muối cacboxylat khan (trong đó có một muối đơn chức và một muối đa chức). Giá trị của a gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
E gồm CnH2n+3O2N (u mol) và CmH2m+4O4N2 (v mol)
nE = u + v = 0,2
nO2 = u(1,5n – 0,25) + v(1,5m – 1) = 0,58
nH2O = u(n + 1,5) + v(m + 2) = 0,84
—> u = 0,08; v = 0,12; nu + mv = 0,48
—> 2n + 3m = 12
Do n ≥ 1 và m ≥ 2 nên n = 3 và m = 2 là nghiệm duy nhất.
Sản phẩm chỉ có 1 khí duy nhất nên:
Y là C2H5COONH4 (0,08 mol)
X là (COONH4)2 (0,12 mol)
—> Muối gồm C2H5COONa (0,08) và (COONa)2 (0,12)
—> m muối = 23,76
Chọn B
Câu 40:
Thí nghiệm nào sau đây xảy ra ăn mòn điện hóa?
 Xem đáp án
Xem đáp án
A. Không có ăn mòn điện hóa do không có cặp điện cực và môi trường điện li.
B. Không có ăn mòn điện hóa do không có cặp điện cực.
C. Có ăn mòn điện hóa do có cặp điện cực (Fe-C), môi trường điện li (không khí ẩm) và chúng có tiếp xúc với nhau.
D. Không có ăn mòn điện hóa do không có cặp điện cực
Chọn C
