(2023) Đề thi thử Hóa THPT Vĩnh Linh, Quảng Trị (Lần 1) có đáp án
(2023) Đề thi thử Hóa THPT Vĩnh Linh, Quảng Trị (Lần 1) có đáp án
-
1106 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 4:
Dầu ca cao có hàm lượng gốc axit béo no (stearat và panmitat) đến 75% còn lại là gốc axit béo không no. Công thức của axit stearic là
 Xem đáp án
Xem đáp án
Chọn D
Câu 7:
X là kim loại dẫn điện tốt nhất. Người ta có thể chia X ở kích thước nhỏ (nanomet). Ion X+ có khả năng diệt khuẩn rất lớn. X là
 Xem đáp án
Xem đáp án
Chọn C
Câu 9:
Nước rửa tay khô (dùng để phòng chống COVID-19) có chứa glixrerol và một số chất khác. Số nhóm hidroxyl (OH) trong phân tử Glixerol là
 Xem đáp án
Xem đáp án
Chọn A
Câu 13:
Khi sản xuất nhôm bằng cách điện phân nóng chảy Al2O3, người ta trộn nó với criolit. Hỗn hợp này có nhiệt độ nóng chảy thấp hơn nhiều so với Al2O3. Công thức hóa học của criolit là
 Xem đáp án
Xem đáp án
Chọn C
Câu 16:
Khí sunfurơ không màu, mùi hắc, là một trong những chất gây ô nhiễm môi trường, là nguyên nhân chính gây mưa axit. Công thức hóa học của khí sunfurơ là
 Xem đáp án
Xem đáp án
Chọn B
Câu 19:
Canxi hidrocacbonat dễ bị phân hủy thành canxi cacbonat, hơi nước và khí cacbonic (là cơ sở giải thích sự tạo thành thạch nhũ trong hang động núi đá vôi). Công thức của canxi cacbonat là
 Xem đáp án
Xem đáp án
Chọn A
Câu 21:
Cho các polime sau: poli(vinyl clorua), poli(metyl metacrylat), poli(hexametylenađipamit), poliacrilonitrin, polibutađien. Số polime điều chế từ phản ứng trùng hợp là
 Xem đáp án
Xem đáp án
Các polime điều chế từ phản ứng trùng hợp là: poli(vinyl clorua), poli(metyl metacrylat), poliacrilonitrin, polibutađien.
Chọn C
Câu 22:
Để khử hoàn toàn 6,96 gam Fe3O4 thành Fe cần V lit khí CO ở nhiệt độ cao. Giá trị của V quy về điều kiện tiêu chuẩn là
 Xem đáp án
Xem đáp án
Fe3O4 + 4CO —> 3Fe + 4CO2
nFe3O4 = 0,03 —> nCO = 0,12 —> V = 2,688 lít
Chọn A
Câu 23:
Cho 200 ml dung dịch glucozơ 1M tác dụng với lượng dư dung dịch AgNO3 trong NH3, đun nóng nhẹ, thu được m gam Ag. Biết phản ứng xảy ra hoàn toàn. Giá trị m là
 Xem đáp án
Xem đáp án
nC6H12O6 = 0,2 —> nAg = 0,4 —> mAg = 43,2 gam
Chọn D
Câu 24:
Cho 8,4 gam hỗn hợp X gồm Fe và CaO tác dụng vừa đủ với V ml dung dịch HCl 0,5M. Giá trị của V là
 Xem đáp án
Xem đáp án
Fe + 2HCl —> FeCl2 + H2
CaO + 2HCl —> CaCl2 + H2O
nX = 8,4/56 = 0,15 —> nHCl = 0,3 —> Vdd = 600 ml
Chọn D
Câu 25:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Sai, trong phản ứng tráng bạc, glucozơ đóng vai trò là chất khử: glucozơ khử Ag+ thành Ag.
B. Sai, saccarozơ thủy phân trong môi trường axit tạo ra glucozơ và saccarozơ.
C. Đúng
D. Sai, tinh bột và xenlulozơ đều không tan trong nước. Trong nước nóng tinh bột tan được một phần.
Chọn C
Câu 26:
Phản ứng nào sau đây chứng tỏ FeO là một oxit bazơ?
 Xem đáp án
Xem đáp án
Phản ứng D FeO đóng vai trò là oxit bazơ, các phản ứng còn lại FeO đóng vai trò chất khử hoặc chất oxi hóa.
Chọn D
Câu 27:
Trung hòa m gam axit glutamic cần 300 ml dung dịch NaOH 0,1M. Giá trị m là
 Xem đáp án
Xem đáp án
H2NC3H5(COOH)2 + 2NaOH —> H2NC3H5(COONa)2 + 2H2O
nNaOH = 0,03 —> nGlu = 0,015 —> mGlu = 2,205 gam
Chọn B
Câu 28:
Este E có công thức phân tử C4H8O2. Thủy phân E trong dung dịch NaOH dư, thu được sản phẩm gồm ancol metylic và muối M. Công thức phân tử của M là
 Xem đáp án
Xem đáp án
C2H5COOCH3 + NaOH —> C2H5COONa + CH3OH
Muối M là C2H5COONa hay C3H5O2Na.
Chọn B
Câu 29:
Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4 và Cu vào dung dịch HCl dư, thấy có 0,7 mol axit phản ứng và còn lại 0,35a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp A bằng H2 dư, thu được 34,4 gam chất rắn. Phần trăm khối lượng Cu trong hỗn hợp A gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nHCl = 0,7 —> nH2O = 0,35 —> nO = 0,35
Đặt x, y là số mol Fe và Cu trong A
—> 56x + 64y = 34,4 (1)
và mA = a = 34,4 + mO = 40
—> mCu dư = 0,35a = 14
—> nCu pư = y – 0,21875
Bảo toàn điện tích cho dung dịch muối:
2x + 2(y – 0,21875) = 0,7 (2)
Giải hệ (1)(2) —> x = 0,25 & y = 0,31875
—> %Cu = 51%
Chọn D
Câu 30:
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Trộn 1 gam bột CH3COONa và 2 gam vôi tôi xút (CaO + NaOH) rồi cho vào ống nghiệm khô có lắp ống dẫn khí.
Bước 2: Đun nóng ống nghiệm bằng đèn cồn.
Bước 3: Lắp ống thủy tinh vuốt nhọn vào đầu ống dẫn khí rồi đốt.
Bước 4: Dẫn khí sinh ra vào dung dịch nước brom.
Cho các phát biểu sau:
(a) Thí nghiệm trên sinh ra chất khí là một hidrocacbon đơn giản nhất.
(b) CaO đóng vai trò là chất xúc tác cho phản ứng.
(c) Ở bước 3, ngọn lửa cháy có màu vàng nhạt.
(d) Ở bước 4, dung dịch nước brom mất màu.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng: CH3COONa + NaOH —> CH4 + Na2CO3
(b) Đúng
(c) Đúng: CH4 cháy với ngọn lửa vàng nhạt
(d) Sai, CH4 không làm mất màu dung dịch brom.
Chọn D
Câu 31:
Cho các phát biểu sau:
(a) Các monome dùng để tổng hợp tơ nilon-6,6 đều có 6 nguyên tử C.
(b) Dung dịch các amino axit đều làm quì tím hóa hồng.
(c) Ở điều kiện thích hợp, triolein tham gia phản ứng cộng H2.
(d) Metylamin có lực bazơ mạnh hơn anilin.
(e) Thủy phân hoàn toàn 1 mol Gly-Ala-Glu cần 3 mol NaOH.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng, các monome là HOOC-(CH2)4-COOH và H2N-(CH2)6-NH2 đều có 6C
(b) Sai, tùy tương quan số lượng nhóm NH2 và COOH mà dung dịch amino axit có môi trường kiềm, trung tính hoặc axit.
(c) Đúng, triolein là chất béo không no, có 3C=C nên tham gia phản ứng cộng H2.
(d) Đúng, gốc no -CH3 làm tăng tính bazơ, gốc thơm -C6H5 làm giảm tính bazơ.
(e) Sai: Gly-Ala-Glu + 4NaOH —> GlyNa + AlaNa + GluNa2 + 2H2O
Chọn B
Câu 32:
Cho các phát biểu sau:
(a) Trong công nghiệp đạm urê được điều chế từ NH3 và CO2.
(b) Khi điện phân dung dịch (điện cực trơ) chứa AgNO3 và Cu(NO3)2 thì Ag bám vào catot trước.
(c) Đun nóng nước cứng tạm thời sẽ có xuất hiện kết tủa.
(d) Các đồ vật bằng nhôm được bảo vệ bởi lớp màng Al2O3 mỏng, bền.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng, NH3 + CO2 —> (NH2)2CO + H2O
(b) Đúng, Ag+ có tính oxi hóa mạnh hơn Cu2+ nên Ag+ bị điện phân tạo Ag trước.
(c) Đúng: M(HCO3)2 —> MCO3 + CO2 + H2O
(d) Đúng
Chọn D
Câu 33:
Cho sơ đồ chuyển hóa:
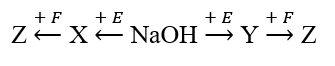
Biết: X, Y, Z, E, F là các hợp chất khác nhau, mỗi mũi tên ứng với một phương trình hóa học khác nhau của phản ứng xảy ra giữa hai chất tương ứng. Các chất E, F thỏa mãn sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
Loại A, C do NaOH + NaHCO3 chỉ có 1 phản ứng với mọi tỉ lệ.
Loại B do KCl không phản ứng được với X, Y.
Chọn D: E là H3PO4, X và Y là 2 trong 3 chất Na3PO4, Na2HPO4, NaH2PO4
Z là Ca3(PO4)2.
Chọn D
Câu 34:
Nhiệt phân hoàn toàn hỗn hợp X gồm NaNO3, Al(NO3)3, Cu(NO3)2, thu được 10 gam chất rắn Y và hỗn hợp khí Z. Hấp thụ khí Z vào 112,5 gam H2O được dung dịch axit có nồng độ 12,5% và có 0,56 lít một khí (đktc) duy nhất thoát ra. Phần trăm khối lượng của NaNO3 trong hỗn hợp X là
 Xem đáp án
Xem đáp án
4NO2 + O2 + 2H2O —> 4HNO3
4x………..x……………………4x
mHNO3 = 63.4x = 12,5%(112,5 + 46.4x + 32x)
—> x = 0,0625
Khí thoát ra là O2 dư (0,025)
—> mX = mY + mZ = 24,3
nNaNO3 = 2nO2 dư = 0,05 —> %NaNO3 = 17,49%
Chọn C
Câu 35:
Cho 20 gam hỗn hợp X gồm Fe, FeCO3, Fe2O3 vào ống sứ nung nóng và dẫn từ từ 0,2 mol hỗn hợp khí Y gồm CO và H2 (tỉ khối so với H2 bằng 4,25) qua ống sứ, sau một thời gian thu được hỗn hợp rắn X1 và khí Y1. Cho khí Y1 hấp thụ vào dung dịch Ca(OH)2 dư, thu được 7 gam kết tủa và 0,06 mol khí Y2 (tỉ khối so với H2 bằng 7,5). Hoà tan X1 bằng dung dịch HNO3 (đặc, nóng, dư), thu được dung dịch Z và 0,62 mol hỗn hợp 2 khí, trong đó có một khí màu nâu đỏ là sản phẩm khử duy nhất của N+5. Nếu cho X tác dụng với dung dịch H2SO4 (đặc, nóng, dư) thì thu được 0,225 mol hỗn hợp 2 khí. Phần trăm khối lượng của Fe2O3 trong X là
 Xem đáp án
Xem đáp án
Đặt a, b, c là số mol Fe, FeCO3, Fe2O3 trong X
—> mX = 56a + 116b + 160c = 20 (1)
X với H2SO4:
nSO2 + nCO2 = (3a + b)/2 + b = 0,225 (2)
Khí Y chứa nCO = 0,05 & nH2 = 0,15
Khí Y2 chứa nCO = nH2 = 0,03
—> nCO pư = 0,02 & nH2 pư = 0,12
X1 với HNO3 thu được NO2 & CO2
Bảo toàn electron:
nNO2 = 3a + b + 0,02.2 + 0,12.2 = 3a + b + 0,28
Bảo toàn C:
nCO2 = b + 0,02 – 0,07 = b – 0,05
—> nNO2 + nCO2 = (3a + b + 0,28) + (b – 0,05) = 0,62 (3)
(1)(2)(3) —> a = 0,09; b = 0,06; c = 0,05
—> %Fe2O3 = 40%
Chọn B
Câu 36:
X là este no, đơn chức; Y là este no, hai chức; Z là este không no, ba chức chứa một liên kết C=C (X, Y, Z đều mạch hở). Đun nóng 24,08 gam hỗn hợp E chứa X, Y, Z với dung dịch NaOH vừa đủ, thu được hỗn hợp chứa hai muối của hai axit cacboxylic đều đơn chức và hỗn hợp T gồm ba ancol no có cùng số nguyên tử C, phân tử khối nhỏ hơn 100 (đvC). Dẫn T qua bình đựng Na dư, thấy khối lượng bình tăng 11,68 gam. Đốt cháy hoàn toàn hỗn hợp muối, thu được CO2, 0,42 mol H2O và 0,14 mol Na2CO3. Phần trăm khối lượng của Y có trong hỗn hợp E là
 Xem đáp án
Xem đáp án
Các muối đều đơn chức nên các este đa chức tạo bởi ancol đa chức.
T gồm ba ancol no có cùng số nguyên tử C, phân tử khối nhỏ hơn 100 (đvC) là C3H7OH, C3H6(OH)2 và C3H5(OH)3.
nNaOH = 2nNa2CO3 = 0,28
—> mT = m tăng + mH2 = 11,68 + 2.0,28/2 = 11,96
Bảo toàn khối lượng —> m muối = 23,32
Quy đổi muối thành HCOONa (a), C2H3COONa (b) và CH2 (c)
nNaOH = a + b = 0,28
nH2O = 0,5a + 1,5b + c = 0,42
m muối = 68a + 94b + 14c = 23,32
—> a = 0,25; b = 0,03; c = 0,25
Muối gồm CH3COONa (0,25) và C2H3COONa (0,03)
—> nC3H5(OH)3 = 0,03
Đặt x, y là số mol C3H7OH, C3H6(OH)2
—> nNaOH = x + 2y + 0,03.3 = 0,28
mAncol = 60x + 76y + 0,03.92 = 11,96
—> x = 0,09; y = 0,05
X là CH3COOC3H7: 0,09
Y là (CH3COO)2C3H6: 0,05 —> %Y = 33,22%
Z là (CH3COO)2(C2H3COO)C3H5: 0,03
Chọn A
Câu 37:
Nung nóng a mol hỗn hợp X gồm propen, axetilen và hidro với xúc tác Ni trong bình kín (giả sử chỉ xảy ra phản ứng cộng H2) thu được hỗn hợp khí Y có tỉ khối so với O2 là 1,0875. Đốt cháy hết Y, thu được 0,024 mol CO2 và 0,03 mol H2O. Biết các phản ứng xảy ra hoàn toàn. Thành phần phần trăm về thể tích propen trong X là
 Xem đáp án
Xem đáp án
mX = mY = mC + mH = 0,348
—> nY = 0,348/(1,0875.32) = 0,01
Dễ thấy nH2O – nCO2 < nY nên Y không còn H2 dư.
Đặt x, y, z là số mol C3H6, C2H2 và H2 trong X
nCO2 = 3x + 2y = 0,024
nH2O = 3x + y + z = 0,03
nY = x + y = 0,01
—> x = 0,004; y = 0,006; z = 0,012
—> %VC3H6 = 18,18%
Chọn C
Câu 38:
Điện phân (với điện cực trơ, màng ngăn xốp) dung dịch X chứa CuSO4 và NaCl (có tỉ lệ mol tương ứng 3 : 2) bằng dòng điện một chiều có cường độ 5 A, sau thời gian t giờ thu được dung dịch Y chứa hai chất tan và thấy khối lượng dung dịch Y giảm 33,1 gam so với khối lượng của dung dịch X. Dung dịch Y hòa tan tối đa 3,6 gam Al. Giả sử khí sinh ra trong quá trình điện phân thoát hết ra khỏi dung dịch. Giá trị của t gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đặt nCuSO4 = 3x và nNaCl = 2x
Y chứa hai chất tan gồm SO42- (3x), Na+ (2x) —> H+ (4x)
Bảo toàn electron —> nH+ = 3nAl —> 4x = 3.3,6/27
—> x = 0,1
Catot: nCu = 0,3 và nH2 = a
Anot: nCl2 = 0,1 và nO2 = b
Bảo toàn electron: 0,3.2 + 2a = 4b + 0,1.2
m giảm = 0,3.64 + 2a + 32b + 0,1.71 = 33,1
—> a = b = 0,2
—> ne = 0,3.2 + 2a = It/F
—> t = 19300s = 5,36h
Chọn C
Câu 39:
Hỗn hợp X gồm glyxin alanin, valin và axit glutamic. Hỗn hợp Y gồm tristearin và tripanmitin. Đốt cháy hoàn toàn 0,3 mol hỗn hợp X gồm a gam X và b gam Y cần dùng 3,885 mol O2, sản phẩm cháy gồm N2, CO2 và 51,3 gam H2O. Đun nóng b gam Y với dung dịch KOH dư, thu được m gam glixerol. Giá trị của m là
 Xem đáp án
Xem đáp án
Quy đổi E thành H2 (0,3), CO2, CH2 (x), NH (y)
nO2 = 0,3.0,5 + 1,5x + 0,25y = 3,885
nH2O = 0,3 + x + 0,5y = 2,85
—> x = 2,46; y = 0,18
nX = nNH = 0,18 —> nY = nE – nX = 0,12
—> nC3H5(OH)3 = 0,12 —> m = 11,04
Chọn C
Câu 40:
Cho sơ đồ phản ứng theo đúng tỉ lệ mol, các kí hiệu đều là hợp chất hữu cơ.
X + 3NaOH → X1 + X2 + X3 + X4
X1 + HCl → A1 + NaCl.
X2 + 2HCl → A2 + 2NaCl.
X4 + CuO → A3 + Cu + H2O
Biết X mạch hở, có công thức phân tử C8H12O6. Mỗi kí hiệu là một chất hữu cơ khác nhau.Trong thành phần của X1 cũng như X2 thì số mol Na bằng số mol C. Phân tử khối của X1 nhỏ hơn của X2. X4 sinh ra từ quá trình lên men rượu glucozơ. Cho các phát biểu sau:
(a) Phân tử khối của X3 là 76.
(b) Từ X4 có thể điều chế trực tiếp axit axetic.
(c) Chất A1 có nhiệt độ sôi cao hơn X4.
(d) Đốt cháy hoàn toàn 1 mol X2 thu được 2 mol CO2.
(e) X3 là hợp chất hữu cơ tạp chức.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
X4 sinh ra từ quá trình lên men rượu glucozơ —> X4 là C2H5OH
—> A3 là CH3CHO
Trong thành phần của X1 cũng như X2 thì số mol Na bằng số mol C và MX1 < MX2 —> X1 là HCOONa và X2 là (COONa)2.
—> A1 là HCOOH; A2 là (COOH)2
X là:
HCOO-CH2-CH2-CH2-OOC-COO-C2H5
HCOO-CH2-CH(CH3)-OOC-COO-C2H5
HCOO-CH(CH3)-CH2-OOC-COO-C2H5
X3 là C3H6(OH)2.
(a) Đúng
(b) Đúng: C2H5OH + O2 —> CH3COOH + H2O
(c) Đúng, MA1 = MX4 nhưng A1 có liên kết H liên phân tử bền hơn X4 nên A1 có nhiệt độ sôi cao hơn X4.
(d) Sai, đốt 1 mol X2 thu 1 mol CO2:
(COONa)2 + 0,5O2 —> Na2CO3 + CO2
(e) Sai, X3 là chất đa chức.
Chọn D
