(2023) Đề thi thử Hóa học Chuyên Lam Sơn, Thanh Hóa (Lần 2) có đáp án
(2023) Đề thi thử Hóa học Chuyên Lam Sơn, Thanh Hóa (Lần 2) có đáp án
-
971 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Kim loại nào sau đây tác dụng với dung dịch CuSO4 tạo thành kết tủa màu xanh
 Xem đáp án
Xem đáp án
Kim loại Na tác dụng với dung dịch CuSO4 tạo thành kết tủa màu xanh:
Na + H2O → NaOH + H2
NaOH + CuSO4 → Cu(OH)2↓ (xanh) + Na2SO4
Chọn D
Câu 3:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
D không đúng, tơ nitron được điều chế bằng phản ứng trùng hợp acrilonitrin.
Chọn D
Câu 4:
Chất có khả năng làm mềm nước có tính cứng tạm thời là :
 Xem đáp án
Xem đáp án
Dùng Ca(OH)2 vừa đủ để làm mềm nước có tính cứng tạm thời:
Ca(OH)2 + M(HCO3)2 → CaCO3 + MCO3 + H2O
(M là Mg, Ca)
Chọn A
Câu 6:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Sai, các vật bằng gang, thép để trong không khí ẩm bị đồng thời ăn mòn hóa học và ăn mòn điện hóa.
Chọn A
Câu 8:
Cho m gam hỗn hợp X gồm Fe và Cu tác dụng với dung dịch HNO3 đun nóng, sau khi phản ứng kết thúc thu được 4,48 lít hỗn hợp khí Y gồm NO, NO2 (không còn sản phẩm khử nào khác của N+5) có tỉ khối hơi so với H2 bằng 19 và còn lại 13,2 gam chất Z rắn gồm 2 kim loại. Giá trị của m là :
 Xem đáp án
Xem đáp án
Y gồm NO (0,1) và NO2 (0,1)
Z gồm 2 kim loại là Fe và Cu → Chỉ có Fe phản ứng.
Bảo toàn electron: 2nFe phản ứng = 3nNO + nNO2
→ nFe phản ứng = 0,2
→ mX = 0,2.56 + 13,2 = 24,4 gam
Chọn C
Câu 11:
Màu nào sau đây xuất hiện khi nhỏ vài giọt dung dịch lòng trắng trứng vào Cu(OH)2/NaOH?
 Xem đáp án
Xem đáp án
Chọn B
Câu 13:
Thuỷ phân 486 gam tinh bột với hiệu suất phản ứng là 75%, khối lượng glucozơ thu được là
 Xem đáp án
Xem đáp án
(C6H10O5)n + nH2O → C6H12O6
→ mC6H12O6 = 75%.486.180/162 = 405 gam
Chọn D
Câu 16:
Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy
 Xem đáp án
Xem đáp án
Chọn B
Câu 18:
Dung dịch NaHCO3 không phản ứng được với chất nào sau đây?
 Xem đáp án
Xem đáp án
A. NaOH + NaHCO3 → Na2CO3 + H2O
B. HCl + NaHCO3 → NaCl + CO2 + H2O
C. Na + H2O → NaOH + H2
NaOH + NaHCO3 → Na2CO3 + H2O
D. Không phản ứng.
Chọn D
Câu 19:
Xét các dãy chuyển hoá: Alanin + NaOH → A; A + HCl → X (A, X là hợp chất hữu cơ, NaOH và HCl đều dư). Chất X là :
 Xem đáp án
Xem đáp án
A là H2N-CH(CH3)-COONa
X là ClH3N-CH(CH3)-COOH
Chọn B
Câu 21:
Chất nào sau đây khi ở trạng thái rắn có tính thăng hoa, còn được gọi là “nước đá khô”?
 Xem đáp án
Xem đáp án
Chọn C
Câu 22:
Cho lượng FeCl2 dư lần lượt tác dụng với các dung dịch: NaOH, HCl, AgNO3, H2SO4 đặc. Sau khi các phản ứng xảy ra hoàn toàn, số dung dịch tạo thành kết tủa là
 Xem đáp án
Xem đáp án
Có 2 dung dịch tạo thành kết tủa là:
NaOH + FeCl2 → Fe(OH)2 + NaCl
AgNO3 + FeCl2 → AgCl + Fe(NO3)2
HCl không phản ứng, H2SO4 có phản ứng nhưng không tạo kết tủa.
Chọn B
Câu 23:
Một hemoglobin (hồng cầu của máu) chứa 0,4% Fe về khối lượng (mỗi phân tử hemoglobin chỉ chứa 1 nguyên tử Fe). Phân tử khối gần đúng của hemoglobin trên là :
 Xem đáp án
Xem đáp án
M hemoglobin = 56/0,4% = 14000
Chọn C
Câu 24:
Cho a gam hỗn hợp X gồm 2 chất hữu cơ mạch hở (phân tử chỉ chứa C, H, O) phản ứng vừa đủ với 100 ml dung dịch KOH 5M, thu được m gam hỗn hợp 2 muối của 2 axit cacboxylic no đơn chức và 1 ancol no đơn chức Y. Cho Y tác dụng hết với Na thu được 3,36 lít H2. Nếu đốt cháy hoàn toàn a gam X thì thu được 29,12 lít khí CO2. Giá trị của m là
 Xem đáp án
Xem đáp án
nH2 = 0,15 → nY = 0,3 < nKOH = 0,5 nên X gồm ACOOR (0,3) và BCOOH (0,2), số C tương ứng là x, y
nCO2 = 0,3x + 0,2y = 1,3 → 3x + 2y = 13
→ x = 3 và y = 2 là nghiệm duy nhất
Sản phẩm có 2 muối nên X gồm HCOOC2H5 (0,3) và CH3COOH (0,2)
Muối gồm HCOONa (0,3), CH3COONa (0,2) → m = 36,8 gam
Chọn C
Câu 25:
Chất nào sau đây không bị nhiệt phân?
 Xem đáp án
Xem đáp án
A. NH4Cl → NH3 + HCl
B. Al2O3 không bị nhiệt phân.
C. Al(OH)3 → Al2O3 + H2O
D. NaHCO3 → Na2CO3 + CO2 + H2O
Chọn B
Câu 26:
Hiện tượng ăn mòn điện hoá học xảy ra khi cho một chiếc đinh làm bằng thép vào
 Xem đáp án
Xem đáp án
Ăn mòn điện hóa cần môi trường điện li → Cho đinh làm bằng thép vào dung dịch NaCl sẽ có ăn mòn điện hóa.
Chọn B
Câu 27:
Nung nóng hoàn toàn m gam hỗn hợp X gồm Fe2O3 và Al, thu được hỗn hợp Y. Để phản ứng vừa đủ với hỗn hợp Y cần 200ml dung dịch NaOH 2M, thu được 3,36 lít H2. Giá trị của m là
 Xem đáp án
Xem đáp án
nAl ban đầu = nNaOH = 0,4
nH2 = 0,15 → nAl dư = 0,1 → nAl phản ứng = 0,3 → nFe2O3 = 0,15
→ mX = 34,8 gam
Chọn C
Câu 29:
Phản ứng nhiệt nhôm xảy ra khi cho nhôm tác dụng với chất nào sau đây ở nhiệt độ cao?
 Xem đáp án
Xem đáp án
Chọn A
Câu 30:
Thuỷ phân este X thu được ancol etylic và axit propionic. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
X + H2O → C2H5COOH + C2H5OH
→ X là C2H5COOC2H5 (C5H10O2)
Chọn D
Câu 31:
Một mẫu cồn X (thành phần chính là C2H5OH) có lẫn tạp chất CH3OH. Khi được đốt cháy hoàn toàn, 1 mol C2H5OH toả ra lượng nhiệt là 1370 kJ và 1 mol CH3OH toả ra lượng nhiệt là 716 kJ. Đốt cháy hoàn toàn 50 gam cồn X, thu được lượng nhiệt là 1167,6 kJ (giả sử lượng nhiệt thất thoát là 20%). Phần trăm khối lượng tạp chất CH3OH trong mẫu cồn là :
 Xem đáp án
Xem đáp án
50 gam cồn X chứa C2H5OH (a) và CH3OH (b)
→ mX = 46a + 32b = 50
Nhiệt thu được = 80%(1370a + 716b) = 1167,6
→ a = 1; b = 0,125
→ %CH3OH = 8%
Chọn C
Câu 32:
Cho các phát biểu sau:
(a) Tơ lapsan được điều chế bằng phản ứng trùng ngưng.
(b) Peptit Gly-Ala-Ala-Val tham gia phản ứng màu biure.
(c) Ở điều kiện thường, phenol là chất lỏng.
(d) Dầu ăn để ngoài không khí bị oxi hóa chậm thành các hợp chất độc hại.
(e) Glucozơ dùng làm thuốc tăng lực cho người già và người ốm.
(g) Lòng trắng trứng chứa nhiều protein và bị đông tụ khi đun nóng.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng, trùng ngưng C2H4(OH)2 và p-C6H4(COOH)2 thu được tơ lapsan.
(b) Đúng, tripeptit trở lên có phản ứng màu biure.
(c) Sai, phenol là chất rắn ở điều kiện thường.
(d)(e)(g) Đúng
Chọn A
Câu 33:
Hợp chất hữu cơ no, đa chức X có công thức phân tử C7H12O4. Cho 0,1 mol X tác dụng vừa đủ với 100 gam dung dịch NaOH 8% thu được chất hữu cơ Y đa chức và 17,8 gam hỗn hợp muối của các axit cacboxylic. Cho các phát biểu sau:
(a) Chất X có 4 công thức cấu tạo.
(b) Chất Y có khả năng hoà tan Cu(OH)2 ở nhiệt độ thường.
(c) Nung nóng 1 trong 2 muối trên với hỗn hợp vôi tôi xút thu được khí CH4.
(d) Chất X có khả năng tham gia phản ứng tráng bạc.
Số phát biểu sai là :
 Xem đáp án
Xem đáp án
X + NaOH → Hỗn hợp muối nên X là este 2 chức tạo bởi ancol 2 chức và 2 axit đơn chức
→ nRCOONa = 2nX = 0,2
M muối = R + 67 = 17,8/0,2 → R = 22
Do hai muối có số mol bằng nhau nên hai gốc muối là CH3- (15) và C2H5- (29)
→ X là CH3COO–(CH2)2–OOCC2H5.
Y là C2H4(OH)2
(a) Sai, X có 1 cấu tạo.
(b) Đúng
(c) Đúng: CH3COONa + NaOH → CH4 + Na2CO3
(d) Sai.
Chọn B
Câu 34:
Cho các phát biểu sau:
(a) Cho dung dịch NaOH vào dung dịch FeCl2 có xuất hiện kết tủa màu xanh.
(b) Nhiệt phân hoàn toàn NaHCO3 tạo thành Na2O.
(c) Hỗn hợp BaO và Al2O3 (tỷ lệ mol 1 : 1) tan hết trong nước dư.
(d) Na2CO3 dùng trong công nghiệp sản xuất giấy.
(e) Trong tro bếp chứa nhiều K2SO4 dùng để làm phân bón cho cây trồng.
Số phát biểu đúng là.
 Xem đáp án
Xem đáp án
(a) Sai, kết tủa Fe(OH)2 màu trắng hơi xanh.
(b) Sai, NaHCO3 → Na2CO3 + CO2 + H2O
(c) Đúng: BaO + Al2O3 → Ba(AlO2)2
(d) Đúng
(e) Sai, tro bếp chứa nhiều K2CO3 dùng để làm phân bón cho cây trồng.
Chọn B
Câu 35:
Dẫn lượng dư hỗn hợp X (gồm hơi nước và khí CO) qua m (gam) cacbon nung đỏ thu được hỗn hợp Y gồm CO, H2, CO2 và hơi nước. Cho Y đi qua bình đựng CuO, Fe2O3 dư nung nóng thu được chất rắn Z và khí T. Z tác dụng với dung dịch HNO3 dư thu được 8,064 lít NO là sản phẩm khử duy nhất. Hấp thụ hoàn toàn T vào dung dịch mol Ba(OH)2 dư thấy xuất hiện 59,1 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn, các khí đo ở đktc. Giá trị của m là
 Xem đáp án
Xem đáp án
Đặt a, b là số mol CO và C ban đầu.
Bảo toàn electron: 2a + 4b = 3nNO
Ba(OH)2 dư → nCO2 = a + b = nBaCO3 = 0,3
→ a = 0,06; b = 0,24
→ mC = 12b = 2,88
Chọn D
Câu 36:
Cho hỗn hợp X gồm ba este mạch hở, trong đó có một este đơn chức và hai este hai chức đồng phân của nhau. Đốt cháy hoàn toàn 11,88 gam X cần 14,784 lít O2, thu được 25,08 gam CO2. Đun nóng 11,88 gam X với 300 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thu được chất rắn Y và phần hơi chỉ chứa một ancol Z. Lấy toàn bộ Z cho vào bình đựng Na dư, thấy khối lượng chất rắn trong bình đựng Na tăng 5,85 gam. Trộn Y với CaO rồi nung trong điều kiện không có không khí, thu được 2,016 lít một hidrocacbon duy nhất. Các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của este đơn chức trong X là:
 Xem đáp án
Xem đáp án
nO2 = 0,66; nCO2 = 0,57
Bảo toàn khối lượng tính được nH2O = 0,44
X gồm: ACOOB (x mol) và BOOC-R-COOB (y mol)
Bảo toàn O ta có: 2x + 4y = 0,26
→ nNaOH pư = x + 2y = 0,13 → nNaOH dư = 0,17
Các phản ứng vôi tôi xút chất rắn Y:
ACOONa + NaOH → AH + Na2CO3
R(COONa)2 + 2NaOH → RH2 + 2Na2CO3
Dễ nhận thấy NaOH vẫn dư trong 2 phản ứng trên, vậy:
nAH + nRH2 = x + y = 0,09
→ x = 0,05 và y = 0,04
Phần ancol BOH (x + 2y = 0,13 mol) vào bình Na dư:
m bình tăng = 0,13(B + 17) – 0,13.2/2 = 5,85
→ B = 29 → C2H5OH
m este = 0,05(A + 73) + 0,04(R + 146) = 11,88
Do R = A – 1 (Vì chỉ thu được 1 hidrocacbon khi vôi tôi xút nên AH cũng là RH2) nên tính được:
A = 27 → CH2=CH-
Vậy các este là:
CH2=CH-COOC2H5 (0,05 mol)
C2H5-OOC-C2H2-COO-C2H5 (0,04 mol)
→ %CH2=CH-COOC2H5 = 42,09%
Chọn B
Câu 37:
Hỗn hợp T gồm 2 este đơn chức X, Y (MX < MY). Đun nóng 15,72 gam T với một lượng dung dịch NaOH vừa đủ, thu được m gam hỗn hợp Z gồm 2 ancol (có phân tử khối hơn kém nhau 14 đ.v.C) và hỗn hợp hai muối. Đốt cháy m gam Z, thu được 9,408 lít CO2 và 10,8 gam H2O. Cho các phát biểu sau:
(a) Phần trăm khối lượng của X trong T là 59,2%.
(b) Chất X cho phản ứng tráng gương.
(c) Chất Y có thể làm mất màu dung dịch brom.
(d) Chất Y có đồng phân hình học.
(e) Chất Y có 2 công thức cấu tạo.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đốt ancol Z: nCO2 = 0,42 và nH2O = 0,6
→ nZ = nH2O – nCO2 = 0,18
Số C = nCO2/nZ = 7/3 → Z gồm C2H5OH (0,12) và C3H7OH (0,06)
Vậy các este ban đầu là ACOOC2H5 (0,12) và BCOOC3H7 (0,06)
→ mT = 0,12(A + 73) + 0,06(B + 87) = 15,72
→ 2A + B = 29
→ A = 1 và B = 27 là nghiệm duy nhất.
Vậy X là HCOOC2H5 (0,12) và Y là C2H3COOC3H7 (0,06)
(a) Sai: %X = 56,49%
(b) Đúng, X dạng C2H5-O-CHO nên có tráng gương.
(c) Đúng, Y có C=C nên làm mất màu dung dịch brom.
(d) Sai
(e) Đúng: C2H3COOCH2CH2CH3 và C2H3COOCH(CH3)2
Chọn D
Câu 38:
Hòa tan hết 26,5 gam hỗn hợp bột gồm Mg, Al, AlO3 và MgO bằng 800 ml dung dịch hỗn hợp gồm HCl 0,5M và H2SO4 0,75M. Sau phản ứng thu được dung dịch X và 4,48 lít khí H2. Cô cạn dung dịch X thu được khối lượng muối khan là
 Xem đáp án
Xem đáp án
nHCl = 0,4; nH2SO4 = 0,6; nH2 = 0,2
Bảo toàn H → nH2O = 0,6
m muối = 26,5 – 0,6.16 + 0,4.35,5 + 0,6.96 = 88,7 gam
Chọn A
Câu 39:
Trộn 13,05 gam hỗn hợp gồm CuSO4 và NaCl với dung dịch chứa x mol HCl ta được dung dịch Y. Tiến hành điện phân dung dịch Y với điện cực trơ, màng ngăn xốp, cường độ dòng điện 0,5A, hiệu suất điện phân là 100%. Lượng khí sinh ra từ bình điện phân và lượng kim loại Cu sinh ra ở catot theo thời gian điện phân được cho ở bảng sau:
|
Thời gian điện phân (giây) |
t |
t + 11580 |
3,8t |
|
Lượng khí sinh ra từ bình điện phân (mol) |
a |
a + 0,04 |
5,4a |
|
Lượng kim loại Cu sinh ra ở catot (mol) |
0,025 |
0,045 |
0,045 |
Giá trị của x là:
 Xem đáp án
Xem đáp án
Trong 11580s (tính từ t đến t + 11580) có ne = 0,06
Catot: nCu = 0,045 – 0,025 = 0,02 → nH2 = 0,01
n khí anot = 0,04 – 0,01 = 0,03 → Chỉ có Cl2
→ a = 0,025
nCuSO4 = 0,045 → nNaCl = 0,1
ne lúc t giây = 0,025.2 = 0,05 → ne lúc 3,8t giây = 0,19
Catot: nCu = 0,045 → nH2 = 0,05
Anot: nCl2 = u và nO2 = v
→ u + v + 0,05 = 5,4.0,025 và ne = 2u + 4v = 0,19
→ u = 0,075; v = 0,01
Bảo toàn Cl → nHCl = x = 2u – nNaCl = 0,05
Chọn C
Câu 40:
Cho sơ đổ chuyển hoá sau:
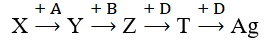
Chất X là thành phần chính của quặng giàu sắt nhất nhưng hiếm gặp trong tự nhiên; Y, Z, T, A, B, D là các chất khác nhau; mỗi mũi tên ứng với một phương trình hoá học của phản ứng giữa hai chất, số oxi hóa của Fe trong Y thấp hơn Fe trong X. Phát biểu nào sau đây không chính xác?
 Xem đáp án
Xem đáp án
Chất X là thành phần chính của quặng giàu sắt nhất nhưng hiếm gặp trong tự nhiên → X là Fe3O4
A là CO, H2, Al…
B là HCl, HBr
Y là Fe hoặc FeO
Z là FeCl2 hoặc FeBr2
D là AgNO3
T là Fe(NO3)2
→ A không chính xác.
Chọn A
