(2023) Đề thi thử Hóa học Cụm Hoàn Kiếm- Hai Bà Trưng, Hà Nội có đáp án
(2023) Đề thi thử Hóa học Cụm Hoàn Kiếm- Hai Bà Trưng, Hà Nội có đáp án
-
236 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Geraniol có trong tinh dầu hoa hồng (công thức cấu tạo thu gọn như hình bên) được sử dụng phổ biến trong công nghiệp hương liệu, thực phẩm,… vì có mùi thơm đặc trưng.
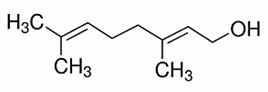
Geraniol thuộc loại hợp chất hữu cơ nào sau đây?
 Xem đáp án
Xem đáp án
Phân tử geraniol có 1 nhóm OH liên kết với gốc hiđrocacbon → Geraniol thuộc loại ancol.
Chọn A
Câu 2:
Để bảo vệ những vật bằng sắt khỏi bị ăn mòn, người ta tráng hoặc mạ lên những vật đó lớp thiếc hoặc lớp kẽm. Làm như vậy để chống ăn mòn kim loại theo phương pháp nào sau đây?
 Xem đáp án
Xem đáp án
Đây là phương pháp bảo vệ bề mặt, dùng Zn che phủ toàn bộ bề mặt vật bằng sắt, ngăn sắt tiếp xúc với môi trường, qua đó bảo vệ được sắt.
Chọn A
Câu 3:
Cặp kim loại nào sau đây đều có phản ứng với dung dịch HCl?
 Xem đáp án
Xem đáp án
Cặp kim loại Al và Mg đều có phản ứng với dung dịch HCl?:
Al + HCl → AlCl3 + H2
Mg + HCl → MgCl2 + H2
Chọn B
Câu 5:
Thạch cao nung là chất rắn màu trắng, dễ nghiền thành bột mịn, thường được dùng để nặn tượng, đúc khuôn, làm phấn viết bảng, bó bột khi gãy xương,… Công thức của thạch cao nung là
 Xem đáp án
Xem đáp án
Chọn C
Câu 7:
Công thức phân tử nào sau đây có thể ứng với một este no, đơn chức, mạch hở?
 Xem đáp án
Xem đáp án
Este no, đơn chức, mạch hở có công thức CnH2nO2 (n ≥ 2) → C4H8O2 ứng với este no, đơn chức, mạch hở.
Chọn B
Câu 11:
Ở trạng thái cơ bản, số electron lớp ngoài cùng của nguyên tử các nguyên tố kim loại kiềm là
 Xem đáp án
Xem đáp án
Chọn B
Câu 12:
Kim loại nhôm không tan được trong dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Kim loại nhôm không tan được trong dung dịch H2SO4 đặc nguội do bị thụ động hóa.
Chọn C
Câu 18:
Kim loại X là chất lỏng ở điều kiện thường. X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. X là
 Xem đáp án
Xem đáp án
Chọn B
Câu 19:
Glucozơ là chất dinh dưỡng được dùng làm thuốc tăng lực cho người già, trẻ em và người ốm. Trong máu người có một lượng nhỏ glucozơ với nồng độ hầu như không đổi khoảng
 Xem đáp án
Xem đáp án
Chọn D
Câu 21:
Este X có công thức phân tử C4H8O2. Thủy phân X trong dung dịch NaOH, đun nóng thu được hai sản phẩm hữu cơ có cùng số nguyên tử cacbon. Công thức cấu tạo thu gọn của X là
 Xem đáp án
Xem đáp án
Hai sản phẩm hữu cơ có cùng số nguyên tử cacbon → Mỗi chất 2C → X là CH3COOC2H5
Chọn A
Câu 22:
Dẫn khí CO dư qua hỗn hợp bột gồm MgO, CuO, Al2O3, Fe3O4 và FeO, nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Số oxit kim loại trong Y là
 Xem đáp án
Xem đáp án
CO khử được các oxit kim loại sau Al → Y chứa 2 oxit kim loại không bị khử là MgO, Al2O3.
Chọn A
Câu 23:
Dung dịch chất X không làm đổi màu quỳ tím; dung dịch chất Y làm quỳ tím hóa xanh. Trộn lẫn hai dung dịch trên thu được kết tủa. Hai chất X và Y tương ứng là
 Xem đáp án
Xem đáp án
Dung dịch chất Y làm quỳ tím hóa xanh → Loại A, D
X + Y tạo kết tủa → Chọn X và Y tương ứng là Ba(NO3)2 và Na2CO3.
Chọn C
Câu 24:
Cho các polime: polietilen, tơ lapsan, poli(vinyl clorua), xenlulozơ axetat, tơ capron, nilon-6,6. Số polime trong phân tử có chứa nguyên tố oxi là
 Xem đáp án
Xem đáp án
Các polime trong phân tử có chứa nguyên tố oxi là:
tơ lapsan, xenlulozơ axetat, tơ capron, nilon-6,6
Chọn C
Câu 25:
Cho dãy các chất: glucozơ, xenlulozơ, saccarozơ, tinh bột, fructozơ. Số chất trong dãy khi thủy phân chỉ tạo ra một loại monosaccarit là
 Xem đáp án
Xem đáp án
Các chất trong dãy khi thủy phân chỉ tạo ra một loại monosaccarit là xenlulozơ, tinh bột.
Chọn D
Câu 26:
Lên men 10 kg tinh bột chứa 19% tạp chất trơ. Giả sử phản ứng lên men xảy ra với hiệu suất 75%. Khối lượng ancol etylic thu được là
 Xem đáp án
Xem đáp án
(C6H10O5)n → nC6H12O6 → 2nC2H5OH
mC2H5OH = 75%.46.2.10.81%/162 = 3,45 kg
Chọn C
Câu 27:
Xà phòng hóa hoàn toàn 16,12 gam chất béo X cần một lượng vừa đủ dung dịch chứa 0,06 mol NaOH. Cô cạn dung dịch sau phản ứng, thu được m gam muối khan. Giá trị của m là
 Xem đáp án
Xem đáp án
nC3H5(OH)3 = nNaOH/3 = 0,02
Bảo toàn khối lượng:
mX + mNaOH = m muối + mC3H5(OH)3
→ m muối = 16,68 gam
Chọn A
Câu 28:
Hòa tan hoàn toàn m gam bột sắt trong dung dịch axit H2SO4 đặc, nóng dư thu được 2,52 lít khí SO2 (sản phẩm khử duy nhất của S+6). Giá trị của m là
 Xem đáp án
Xem đáp án
nSO2 = 0,1125
Bảo toàn electron: 3nFe = nSO2 → nFe = 0,075
→ mFe = 4,2 gam
Chọn C
Câu 29:
Hòa tan hỗn hợp bột gồm x mol Fe và y mol Zn vào dung dịch CuSO4 dư. Sau khi các phản ứng xảy ra hoàn toàn thấy khối lượng dung dịch không thay đổi so với dung dịch trước phản ứng. Tỉ lệ x : y là
 Xem đáp án
Xem đáp án
Khối lượng dung dịch không thay đổi so với dung dịch trước phản ứng → mFe + mZn = mCu
⇔ 56x + 65y = 64(x + y) → y = 8x
→ x : y = 1 : 8
Chọn B
Câu 30:
Cho 4 dung dịch riêng biệt: Na2SO4, NaHSO4, AgNO3 và NaOH. Số dung dịch có khả năng phản ứng với Fe(NO3)2 là
 Xem đáp án
Xem đáp án
Có 3 dung dịch có khả năng phản ứng với Fe(NO3)2 là NaHSO4, AgNO3 và NaOH.
Fe2+ + H+ + NO3- → Fe3+ + NO + H2O
Fe2+ + Ag+ → Fe3+ + Ag
Fe2+ + OH- → Fe(OH)2
Chọn D
Câu 31:
Hỗn hợp X gồm 1 mol amino axit no, mạch hở và 1 mol amin no, mạch hở. X có khả năng phản ứng tối đa với 5 mol HCl hoặc 1 mol NaOH. Đốt cháy hoàn toàn X thu được x mol CO2, 10,5 mol H2O và y mol N2. Giá trị của x và y tương ứng là
 Xem đáp án
Xem đáp án
nN = nHCl = 5 → nN2 = 2,5
Quy đổi hỗn hợp X thành:
CH4: 2 mol ⇐ Tính từ nX + nY
CH2: a
NH: 5 mol ⇐ Tính từ nHCl
COO: 1 mol ⇐ Tính từ nNaOH
Bảo toàn H → a = 4
Bảo toàn C → nCO2 = 7
Chọn D
Câu 32:
Tiến hành các thí nghiệm sau:
(a) Sục khí SO2 vào dung dịch H2S;
(b) Cho Na vào dung dịch CuSO4;
(c) Cho KMnO4 vào dung dịch HCl đặc;
(d) Sục khí CO2 tới dư vào dung dịch NaOH;
(e) Nhiệt phân Mg(NO3)2;
(g) Cho Na2SiO3 vào dung dịch H2SO4.
Số thí nghiệm sinh ra đơn chất khí ở điều kiện thường là
 Xem đáp án
Xem đáp án
(a) SO2 + H2S → S + H2O
(b) Na + H2O → NaOH + H2
NaOH + CuSO4 → Cu(OH)2 + Na2SO4
(c) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
(d) CO2 dư + NaOH → NaHCO3
(e) Mg(NO3)2 → MgO + NO2 + O2
(g) Na2SiO3 + H2SO4 → Na2SO4 + SiO2 + H2O
Chọn A
Câu 33:
Cho các chất hữu cơ no, mạch hở E (C3H4O4) và F (C5H8O5). Từ E, F thực hiện sơ đồ các phản ứng sau theo đúng tỉ lệ mol:
(1) E + 2NaOH → X + Y + H2O
(2) F + 2NaOH → X + Y + Z + H2O
(3) X + HCl → M + NaCl
(4) Y + HCl → T + NaCl
Biết X, Y, Z là các chất hữu cơ, Y và Z có cùng số nguyên tử cacbon. Cho các phát biểu sau:
(a) Chất E là hợp chất hữu cơ tạp chức.
(b) Chất Z có khả năng hòa tan Cu(OH)2 ở điều kiện thường.
(c) Chất X và Z đều có khả năng tham gia phản ứng tráng bạc.
(d) 1 mol chất T khi tác dụng với Na dư thu được tối đa 1 mol khí H2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(3)(4) → X, Y đều có 1Na nên E là HCOO-CH2-COOH
(2) tạo H2O nên F là HCOO-CH2-COO-CHOH-CH3
hoặc HCOO-CH(CH3)-OOC-CH2OH
Y và Z có cùng số nguyên tử cacbon nên:
X là HCOONa; Y là HO-CH2-COONa; Z là CH3CHO
M là HCOOH; T là HO-CH2-COOH
(a) Đúng, E có chức este và chức axit.
(b) Sai, Z không phản ứng với Cu(OH)2 ở điều kiện thường.
(c) Đúng
(d) Đúng, T có 2H linh động nên 1 mol chất T khi tác dụng với Na dư thu được tối đa 1 mol khí H2.
Chọn D
Câu 34:
Cho sơ đồ chuyển hóa:
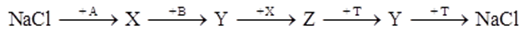
Biết: A, B, X, Y, Z, T là các hợp chất khác nhau; X, Y, Z có chứa natri; MX + MZ = 118; mỗi mũi tên ứng với một phương trình hóa học của phản ứng xảy ra giữa 2 chất tương ứng; các điều kiện phản ứng coi như có đủ. Phân tử khối của chất nào sau đây đúng?
 Xem đáp án
Xem đáp án
MX + MZ = 118 → Chọn MX = 40 (NaOH) và MZ = 78 (Na2S)
A là H2O; X là NaOH
B là H2S, Y là NaHS; Z là Na2S; T là HCl
→ Phân tử khối đúng: MY = 56
Chọn D
Câu 35:
Khí biogas (giả thiết chỉ chứa CH4) và khí gas (chứa C3H8, C4H10 theo tỉ lệ mol 1 : 1) được dùng phổ biến làm nhiên liệu. Nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1 mol các chất được cho trong bảng sau:
|
Chất |
CH4 |
C3H8 |
C4H10 |
|
Nhiệt lượng tỏa ra (kJ) |
890 |
2220 |
2850 |
Giả sử hiệu suất sử dụng các loại nhiên liệu như nhau, khi dùng khí biogas để làm nhiên liệu đốt cháy thay thế khí gas thì lượng khí CO2 thải ra môi trường sẽ
 Xem đáp án
Xem đáp án
Để cung cấp Q kJ nhiệt lượng cho đun nấu:
+ Nếu dùng biogas thì nCH4 = Q/890
nCO2 phát thải = nCH4 = Q/890
+ Nếu dùng gas thì nC3H8 = nC4H10 = x
→ Q = 2220x + 2850x → x = Q/5070
nCO2 phát thải = 3x + 4x = 7Q/5070 > Q/890 nên với cùng 1 nhiệt lượng cung cấp ra thì dùng biogas sẽ phát thải ít CO2 hơn gas.
Lượng CO2 giảm = (7Q/5070 – Q/890) / (7Q/5070) = 18,62%
Chọn B
Câu 36:
Hỗn hợp X gồm 2 chất hữu cơ mạch hở, no đều chứa C, H, O; trong phân tử mỗi chất có 2 nhóm chức trong số các nhóm chức -OH; -CHO; -COOH. Cho m gam X phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 thu được 2,16 gam Ag và 2,79 gam một muối amoni hữu cơ. Cho toàn bộ lượng muối amoni này vào dung dịch NaOH dư, đun nóng thu được 0,03 mol NH3. Giá trị của m là
 Xem đáp án
Xem đáp án
Mỗi chất chứa 2 nhóm chức và tạo 1 muối amoni hữu cơ nên X gồm HO-R-CHO và HO-R-COOH
nHO-R-COONH4 = nNH3 = 0,03
→ 0,03(R + 79) = 2,79 → R = 14
nAg = 0,02 → nHO-CH2-CHO = 0,01
nNH3 = 0,03 → nHO-CH2-COOH = 0,02
→ m = 2,12 gam
Chọn D
Câu 37:
Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 6,72 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dung dịch Y, thu được 46,8 gam kết tủa. Giá trị của m là:
 Xem đáp án
Xem đáp án
nH2 = 0,3 → nAl dư = 0,2
nAl(OH)3 = 0,6 → nAl ban đầu = 0,6 → nAl phản ứng = 0,4
→ nFe3O4 = 0,15
→ m = mAl ban đầu + mFe3O4 = 51 gam
Chọn D
Câu 38:
Điện phân dung dịch X chứa a mol CuSO4, b mol H2SO4, c mol NaCl với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi 5A, hiệu suất điện phân là 100%. Kết quả thí nghiệm được ghi trong bảng sau:
|
Thời gian điện phân (giây) |
t |
2t |
2t + 2702 |
|
Tổng số mol khí ở 2 điện cực (mol) |
0,04 |
0,07 |
x |
|
Khối lượng catot tăng (gam) |
2,56 |
y |
6,4 |
|
Dung dịch sau điện phân |
Y |
Z |
T |
Dung dịch Z có khả năng hòa tan tối đa 2,72 gam CuO. Giá trị của x và b lần lượt là
 Xem đáp án
Xem đáp án
Lúc t giây: nCu = nCl2 = 0,04 → ne = 0,08
Lúc 2t giây: nCu = 0,08; nCl2 = u và nO2 = v
→ u + v = 0,07 và 2u + 4v = 0,08.2
→ u = 0,06; v = 0,01
Khoảng 2702s (tính từ 2t đến 2t + 2702) có ne = 0,14:
Catot: nCu = 0,02 → nH2 = 0,05
Anot: nO2 = 0,14/4 = 0,035
→ x = 0,05 + 0,035 + 0,07 = 0,155
Thời điểm 2t: nNa+ = 2u = 0,12; nCu2+ = 0,02; nH+ = 2nCuO = 0,068, bảo toàn điện tích → nSO42- = 0,114
→ nH2SO4 = b = 0,114 – a = 0,014
Chọn C
Câu 39:
Hỗn hợp E gồm este X ba chức và este Y hai chức với tỉ lệ mol tương ứng là 1 : 3. Xà phòng hóa hoàn toàn a mol E cần dung dịch chứa 3,25a mol NaOH, đun nóng thu được dung dịch F và a mol một ancol duy nhất. Đốt cháy hoàn toàn ancol cần 0,24 mol O2. Cô cạn F được hỗn hợp rắn G, đốt cháy hoàn toàn G cần 0,66 mol O2 thu được Na2CO3, 0,57 mol CO2 và 0,25 mol H2O. Phần trăm khối lượng của X trong E gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nX = 0,25a; nY = 0,75a; tỉ lệ các phản ứng nX : nNaOH = 1 : k và nY + nNaOH = 1 : g
→ nNaOH = 0,25ka + 0,75ga = 3,25a
→ k + 3g = 13
Với 6 ≥ k ≥ 3 và 4 ≥ g ≥ 2 → k = 4; g = 3 là nghiệm duy nhất.
X dạng P-OOC-A-COO-B-COO-R: 0,25a
Y dạng P’-OOC-A’-COO-R: 0,75a
Quy đổi F thành C6H5ONa (a), (COONa)2 (a), HO-CH2-COONa (0,25a), CH2 (b) và H2 (c)
nO2 = 7a + 0,5a + 1,5.0,25a + 1,5b + 0,5c = 0,66
nCO2 = 6a + 2a + 2.0,25a + b – 3,25a/2 = 0,57
nH2O = 2,5a + 1,5.0,25a + b + c = 0,25
→ a = 0,08; b = 0,02; c = 0
F gồm C6H5ONa (0,08), (COONa)2 (0,08), HO-C2H4-COONa (0,02)
Ancol duy nhất là CxHyO (0,08 mol)
CxHyO + (x + 0,25y – 0,5)O2 → xCO2 + 0,5yH2O
nO2 = 0,08(x + 0,25y – 0,5) = 0,24
→ 4x + y = 14 → x = 2, y = 6 là nghiệm duy nhất.
X là C6H5-OOC-COO-C2H4-COO-C2H5: 0,02
Y là C6H5-OOC-COO-C2H5: 0,06
→ %X = 31,37%
Chọn D
Câu 40:
Hòa tan hết 5,26 gam hỗn hợp X gồm Mg, Fe, Fe(NO3)2 bằng dung dịch chứa 0,21 mol HCl và a mol NaNO3 thu được dung dịch Y chỉ chứa 11,06 gam hỗn hợp muối clorua và 0,67 gam hỗn hợp Z gồm 4 khí không màu (trong đó 3 khí có số mol bằng nhau). Dung dịch Y phản ứng tối đa với 0,205 mol KOH thu được 6,8 gam kết tủa. Phần trăm thể tích của khí có phân tử khối nhỏ nhất trong Z là
 Xem đáp án
Xem đáp án
Y + KOH → Dung dịch chứa Na+ (a), K+ (0,205), Cl- (0,21), bảo toàn điện tích → a = 0,005
Bảo toàn khối lượng → nH2O = 0,09
Y chứa Mg2+, Fe2+, Fe3+ (tổng u gam), NH4+ (v mol)
→ u + 18v + 0,005.23 + 0,21.35,5 = 11,06
m↓ = u + 17(0,205 – v) = 6,8
→ u = 3,4; v = 0,005
nNO3-(X) = (5,26 – u)/62 = 0,03
Bảo toàn H → nH2 = 0,005
Bảo toàn N → nN(Z) = 0,03
→ nO(Z) = (mZ – mN – mH2)/16 = 0,015
Z gồm NO, N2, N2O, H2
nO = nNO + nN2O = 0,015; nH2 = 0,005 và 3 khí có cùng số mol → nN2O = nH2 = nN2 = 0,005; nNO = 0,01
%VH2 = 0,005/0,025 = 20%
Chọn D
