(2024) Đề minh họa tham khảo BGD môn Hóa có đáp án (21)
-
93 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 4:
Este nào sau đây tác dụng với dung dịch NaOH tạo thành ancol etylic?
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 5:
Kim loại nào sau đây được điều chế bằng cách điện phân nóng chảy muối halogenua tương ứng?
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 6:
Dung dịch NaOH và dung dịch HCl đều phản ứng được với chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 8:
Thép là hợp kim của sắt với cacbon và một số nguyên tố khác, trong đó hàm lượng cacbon chiếm
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 10:
Một số loại khẩu trang y tế chứa chất bột màu đen (X) có khả năng lọc không khí. Chất (X) là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 12:
Poli (vinylclorua) (PVC) được điều chế từ vinyl clorua bằng phản ứng?
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 17:
Cho dãy các kim loại Mg, Cr, K, Li. Kim loại mềm nhất trong dãy là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 19:
Ở điều kiện thích hợp, kim loại nào sau đây bị Cl2 oxi hóa lên mức oxi hóa +2?
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 20:
Chất béo là thành phần chính trong dầu thực vật và mỡ động vật. Chất nào sau đây là chất béo?
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 21:
Cho dãy các dung dịch: Fructozo, glucozơ, saccarozơ, tinh bột, glixerol. Số dung dịch trong dãy phản ứng được với Cu(OH)2 ở nhiệt độ thường tạo thành dung dịch có màu xanh lam là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 22:
Cho 6,23 gam alanin tác dụng với dung dịch HCl dư, cô cạn cẩn thận dung dịch sau phản ứng, thu được m gam muối khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Ala+ HCl → Ala -HCl
0,07 0,07 0,07
BTKL: m= 6,23 + 0,07.36,5=8,785 gam
Câu 23:
Dãy các chất đều tác dụng được với dung dịch Ba(HCO3)2 là
 Xem đáp án
Xem đáp án
A. Sai NaCl không tác dụng
B. Sai KNO3 không tác dụng
C. Sai NaCl không tác dụng
D. Đúng
Câu 24:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
A. Đúng.
B. Đúng.
C. Đúng.
D. Poli(metyl metacrylat) điều chế bằng phương pháp trùng hợp
Câu 25:
Cho 0,78 gam Cr phản ứng hết với dung dịch HCl (dư), đun nóng, thu được V ml khí (đktc). Giá trị của V là:
 Xem đáp án
Xem đáp án
Cr+ 2HCl CrCl2+ H2
0,015 0,015
V= 0,015.22,4=0,336 lít = 336 ml
Câu 26:
Dẫn V lít khí H2 (đktc) vào dung dịch glucozơ (dư) đun nóng, có xúc tác là Ni, thu được 5,46 gam sobitol. Biết hiệu suất phản ứng là 80%. Giá trị của V là
 Xem đáp án
Xem đáp án
C6H12O6 + H2 C6H14O6
0,03 0,03 0,03
H=80% V= 0,03 .22,4 : 80%= 0,84 lít
Câu 27:
Hấp thụ hoàn toàn 6,72 lít khí CO2 (đktc) vào dung dịch chứa 0,1 mol NaOH và 0,15 mol Ba(OH)2, thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
1< T= <2
CO2+ OH-→ HCO3-
x x x
CO2+ 2OH-→ CO32-+ H2O
y 2y y
x+ y= 0,3
x+ 2y= 0,4
x=0,2; y=0,1
Ba2+ + CO32-→ BaCO3
0,15 0,1 0,1
M= 0,1.197=19,7 gam
Câu 28:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Sai vì Fe +2 FeCl3→ 3FeCl2.
B. Đúng Fe + 2HCl → FeCl2 + H2↑.
C. Đúng Fe3O4 + 8HCl → FeCl2 +2FeCl3 + 4H2O.
D. Đúng vì Fe3+ thể hiện tính oxi hóa: Vì +3 là số oxi hóa cao nhất.
Câu 29:
Cho m gam bột Zn vào 150 ml dung dịch X gồm AgNO3 0,1M và Cu(NO3)2 0,2 M thì được 2,58 gam chất rắn Y. Giá trị của m là
 Xem đáp án
Xem đáp án
\({\rm{2,58 }}\left\{ \begin{array}{l}{\rm{Ag:0,015}}\\{\rm{BTKL:Cu:0,015}}\end{array} \right.\)
\({\rm{dd}}\left\{ \begin{array}{l}{\rm{N}}{{\rm{O}}_{\rm{3}}}^ - :0,075\\{\rm{C}}{{\rm{u}}^{{\rm{2}} + }}{\rm{:0,03 - 0,015}} = {\rm{0,015}}\\{\rm{Z}}{{\rm{n}}^{{\rm{2}} + :}}:0,0225\end{array} \right.\)
m= 0,0225.65=1,4625 (gam)
Câu 30:
Một loại chất béo có chứa 75% tristearin về khối lượng. Để sản xuất 2 nghìn bánh xà phòng cần dùng tối thiểu x kg loại chất béo trên cho phản ứng với dung dịch NaOH, đun nóng. Biết rằng trong mỗi bánh xà phòng có chứa 70 gam natri stearat. Giả sử hiệu suất phản ứng là 85%. Giá trị của x gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
mnatri stearat = 2.103.70 = 140.103 g
PTHH: (C17H35COO)3C3H5 + 3NaOH 3C17H35COONa + C3H5(OH)3
(140.103 : 306:3):85%  (140.103 : 306) mol
(140.103 : 306) mol
m (tristearin) = (140.103 : 306:3):85%.890=159682,174 gam
mchất béo = 159682,174:75% = 212909,565 gam= 212,909 kg
Câu 31:
Rau quả nếu bảo quản trong không khí (21% O2; 0,03% CO2, còn lại là N2 và một số khí khác) thì rau quả sẽ chín nẫu trong vài ngày. Rau quả tươi nếu được bảo quản trong điều kiện hạ thấp hàm lượng oxi xuống dưới 21% và tăng lượng cacbon đioxit (CO2) ở nhiệt độ thích hợp thì thời hạn bảo quản tăng lên đáng kể.
Trong một kho bảo quản quả xoài có diện tích 300m2 và có chiều cao 4m, người ta rút bớt lượng oxi và tăng lượng cacbon đioxit bằng cách đốt metan trong kho kín rồi hạ nhiệt độ xuống 0°C.

 Xem đáp án
Xem đáp án
Thể tích không khí trong phòng V = 300.4 = 1200 m3
- Thể tích CO2 ban đầu \({{\rm{V}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}} = \frac{{0,03.1200}}{{100}} = 0,36\) m3
- Thể tích O2 ban đầu \({{\rm{V}}_{{{\rm{O}}_{\rm{2}}}}} = \frac{{21.1200}}{{100}} = 252\) m3
- Thể tích O2 sau khi rút còn lại: \({{\rm{V}}_{{{\rm{O}}_{\rm{2}}}}} = \frac{{5.1200}}{{100}} = 60\) m3
Thể tích O2 bị rút bớt = 252 – 60 = 192 m3
CH4 + 2O2 CO2 + 2H2O
192m3 96m3
- Thể tích CO2 sau khi rút oxi = 0,36 + 96 = 96,36 m3
- Thể tích khí trong phòng sau khi rút bớt oxi = 1200 – 192 + 96,36 = 1104,36 m3
Hàm lượng CO2 =\( = \frac{{96,36}}{{1104,6}}.100 = 8,73\% \)
Câu 32:
Thực hiện các thí nghiệm sau:
(1) Cho bột Mg vào dung dịch FeCl3 dư.
(2) Cho 1 mol bột Cu vào dung dịch chứa 1,8 mol FeCl3.
(3) Điện phân nóng chảy KCl.
(4) Thổi luồng khí CO đến dư qua ống sứ chứa CuO nung nóng.
(5) Cho Na vào dung dịch CuSO4 dư.
(6) Nung hỗn hợp bột Al2O3 và cacbon trong điều kiện không có không khí.
Số thí nghiệm thu được kim loại sau phản ứng là
 Xem đáp án
Xem đáp án
Các thí nghiệm thu được kim loại là: (2), (3), (4)
(1) Cho bột Mg vào dung dịch FeCl3 dư.
Mg+ 2FeCl3 dư→ 2FeCl2 + MgCl2
(2) Cho 1 mol bột Cu vào dung dịch chứa 1,8 mol FeCl3.
Cu+ 2FeCl3 → 2FeCl2 + CuCl2
1 1,8
Sau phản ứng Cu còn dư
(3) Điện phân nóng chảy KCl.
2KCl 2K+ Cl2
(4) Thổi luồng khí CO đến dư qua ống sứ chứa CuO nung nóng.
CO+ CuO Cu+ H2O
(5) Cho Na vào dung dịch CuSO4 dư.
2Na+ 2H2O→2NaOH+ H2
2NaOH+ CuSO4→Cu(OH)2+ Na2SO4
(6) Nung hỗn hợp bột Al2O3 và cacbon trong điều kiện không có không khí.
Không xảy ra phản ứng
Câu 33:
Cho các phát biểu sau:
(a) Triolein có khả năng tham gia phản ứng cộng hiđro (Ni, to).
(b) Để giảm đau nhức khi bị ong hoặc kiến đốt có thể bôi vôi tôi vào vết đốt.
(c) Xenlulozơ trinitrat được dùng làm thuốc súng không khói.
(d) Tơ visco, tơ nilon–6,6, tơ nitron, tơ axetat là các loại tơ nhân tạo.
(e) Quá trình làm rượu vang từ quả nho xảy ra phản ứng lên men rượu của glucozơ.
(g) Ở nhiệt độ thường amino axit là những chất lỏng, kết tinh, dễ tan trong nước.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
Phát biểu sai là: (d), (g)
(d) Tơ nilon–6,6, tơ nitron là các loại tơ tổng hợp
(g) Ở nhiệt độ thường amino axit là những chất rắn
Câu 34:
Thực hiện thí nghiệm theo các bước sau:
Bước 1: Cho một đinh sắt đã cạo sạch gỉ vào ống nghiệm.
Bước 2: Thêm tiếp vào ống nghiệm 4 - 5 ml dung dịch H2SO4 loãng.
Bước 3: Lấy đinh sắt ra rồi nhỏ dần từng giọt dung dịch KMnO4 trong H2SO4 loãng vào ống nghiệm và lắc đều.
Cho các phát biểu sau:
(a) Trong bước 2, thấy xuất hiện bọt khí màu nâu đỏ.
(b) Trong bước 2, kim loại sắt bị oxi hóa thành hợp chất sắt (II).
(c) Trong bước 3, màu tím của dung dịch KMnO4 nhạt dần.
(d) Trong bước 3, hợp chất mangan (VII) bị oxi hóa thành hợp chất mangan (II).
(e) Dung dịch thu được sau bước (3) không tác dụng được với kim loại Cu.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Fe + H2SO4 loãng FeSO4 + H2
10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
(a) Sai, khí H2 không màu.
(b) Đúng
(c) Đúng
(d) Sai. Trong bước 3, hợp chất mangan (VII) bị khử thành hợp chất mangan (II).
(e) Sai. Có phản ứng: Cu + 2Fe3+ Cu2+ + 2Fe2+
Câu 35:
Tiến hành phản ứng nhiệt nhôm hỗn hợp rắn X gồm Al, FeO, Fe2O3 và Fe3O4 (trong điều kiện không có không khí) thu được hỗn hợp rắn Y. Chia hỗn hợp Y thành 2 phần bằng nhau:
- Phần 1 cho vào dung dịch HNO3 (loãng, dư) thấy thoát ra 16,8 gam khí không màu, hóa nâu trong không khí (sản phẩm khử duy nhất của N+5).
- Phần 2 cho vào dung dịch KOH dư thấy thoát ra 8,064 lít khí H2 (đktc) và còn m gam rắn không tan.
Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là:
 Xem đáp án
Xem đáp án
Phần 1:
Phần 2:
Lấy (2)-(1) : 3y=1,68-0,72
Y= 0,32 vậy mFe = 17,92 gam
Câu 36:
Axit salixylic (chất X) là hoạt chất có trong các chế phẩm dùng ngoài da để điều trị mụn cóc thông thường ở da và bàn chân, loại bỏ chai sạn và sẹo. Ngoài ra, X là nguyên liệu để điều chế thuốc xoa bóp hay thuốc cảm (aspirin). X có công thức cấu tạo như sau:
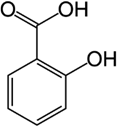
Cho các phát biểu sau:
(a) Công thức phân tử của X là C8H6O3.
(b) X có phản ứng tráng bạc
(c) X tác dụng NaOH theo tỉ lệ mol tối đa là 1:2 tạo sản phẩm có công thức C7H4O3Na2.
(d) X có nhóm chức este và phenol.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai: Công thức phân tử của X là C7H6O3.
(b) Sai: Không có phản ứng tráng bạc
(c) Đúng: C6H4 (OH)(COOH) + 2NaOH → C6H4(ONa)(COONa) + 2H2O
(d) Sai: X có nhóm chức axit và phenol.
Câu 37:
Cho hơi nước đi qua than nóng đỏ thu được hỗn hợp X gồm CO2, CO, H2, H2O. Dẫn X đi qua 25,52 gam hỗn hợp Fe3O4 và FeCO3 nung nóng thu được chất rắn Y gồm Fe, FeO, Fe3O4; hơi nước và 0,2 mol CO2. Chia Y thành 2 phần bằng nhau:
- Phần 1: Hòa tan hết trong dung dịch chứa a mol HNO3 và 0,025 mol H2SO4, thu được 0,1 mol khí NO duy nhất.
- Phần 2: Hòa tan hết trong dung dịch H2SO4 đặc nóng, thu được dung dịch chứa hai muối có số mol bằng nhau và 0,15 mol khí SO2 duy nhất. Giá trị của a là
 Xem đáp án
Xem đáp án
Coi quá trình xảy ra:
Phần 2:
\(\left\{ \begin{array}{l}{{\rm{m}}_{\rm{X}}} = {\rm{232x}} + {\rm{116y}} = {\rm{25,52}}\\{\rm{BTe}} = {\rm{2z}} + {\rm{3}}{\rm{.2z}} = {\rm{0,15,2}} + {\rm{ 2(2x}} + {\rm{1,5y - 0,2)}}\\{\rm{BTFe: 3x}} + {\rm{y}} = {\rm{2(z}} + {\rm{2z)}}\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}{\rm{x}} = {\rm{0,08}}\\{\rm{y}} = {\rm{0,06}}\\{\rm{z}} = {\rm{0,05}}\end{array} \right.\)
Phần 1:
BTĐT: 0,1.3+0,05.2=0,025.2+ (a-0,1)
Vậy: a=0,45
Câu 38:
Chất hữu cơ E có công thức phân tử C8H15O6N; F là este hai chức có một liên kết C=C; E và F đều mạch hở. Đốt cháy hoàn toàn F thì số mol CO2 thu được bằng số mol O2 phản ứng. Thực hiên sơ đồ phản ứng sau:
E + NaOH X + Y + Z + H2O
F + NaOH T + Z
Y + HCl → Y1 + NaCl
T + HCl → T1 + NaCl
Biết X là muối của axit glutamic. Cho các nhận định sau:
(a) Từ Z có thể điều chế trực tiếp ra axit axetic
(b) Cồn y tế 70° dùng sát khuẩn chứa thành chính là chất Z.
(c) Chất F có ba đồng phân cấu tạo thỏa mãn.
(d) Nung T với hỗn hợp vôi tôi xút thu được khí làm nhạt màu dung dịch Brom.
(e) Chất Y có tham gia phản ứng tráng bạc.
Số nhận định đúng là
 Xem đáp án
Xem đáp án
Đốt F có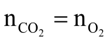 phản ứng nên F có dạng CxH8O4. Mặt khác F có 1 liên kết C=C nên F là C6H8O4
phản ứng nên F có dạng CxH8O4. Mặt khác F có 1 liên kết C=C nên F là C6H8O4
E và F đều tạo ra ancol Z
X là GluNa2 ⇒ E là HCOONH3-C3H5(COOCH3)2
hoặc E là CH3COONH3-C3H5(COOCH3)(COOH)
F là C2H2(COOCH3)2
Y là HCOONa hoặc CH3COONa
Y1 là HCOOH hoặc CH3COOH
Z là CH3OH; T là C2H2(COONa)2
T1 là C2H2(COOH)2
(a) Đúng: CH3OH + CO → CH3COOH (nhiệt độ, xúc tác)
(b) Sai, cồn y tế 70° dùng sát khuẩn chứa thành chính là C2H5OH.
(c) Sai: Có 2 đồng phân
CH3-OOC-CH=CH-COO-CH3
CH3-OOC-C(=CH2)-COO-CH3
(d) Đúng, C2H2(COONa)2 + 2NaOH C2H4 + 2Na2CO3.
C2H4+ Br2→C2H4Br2
(e) Sai, tùy cấu tạo Y có thể tráng bạc hoặc không.
Câu 39:
Hòa tan hết m gam X gồm Cu, CuO, Fe, Fe3O4 trong dung dịch chứa 1,59 mol HCl (dư 25% so với lượng phản ứng) thu được 0,096 mol H2 và 350 gam dung dịch Y. Mặt khác, hòa tan hết m gam X trong dung dịch H2SO4 đặc nóng, thu được dung dịch Z (chứa 3 chất tan) và 0,144 mol SO2 (sản phẩm khử duy nhất của H2SO4). Cho Z tác dụng với dung dịch Ba(OH)2 dư, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 207,372 gam chất rắn. Nồng độ phần trăm FeCl3 trong Y là
 Xem đáp án
Xem đáp án
nHCl ban đầu = nHCl phản ứng + 25%nHCl phản ứng = 1,59
→ nHCl phản ứng = 1,272 mol
Bảo toàn H: nHCl phản ứng = 2nH2 + 2nH2O
→ nO = nH2O = 0,54
nFe > nH2 = 0,096
→ Nếu H2SO4 còn dư thì nSO2 > 1,5nFe > 0,144: Vô lý
Vậy H2SO4 hết → Z chứa Cu2+, Fe2+, Fe3+ và SO42-.
nH2SO4 phản ứng = 2nSO2 + nO = 0,828
Chất rắn gồm CuO (a), Fe2O3 (b) và BaSO4 (0,828 – 0,144 = 0,684)
m rắn = 80a + 160b + 0,684.233 = 207,372
→ a + 2b = 0,6
Dung dịch Y chứa Cu2+, Fe2+ (tổng u mol) và Fe3+ (v mol); Cl-:(1,272 mol)
Bảo toàn kim loại → u + v = 0,6
Bảo toàn điện tích → 2u + 3v = 1,272
→ u = 0,528; v = 0,072
→ C%FeCl3 = (0,072.162,5:350) = 3,3%
Câu 40:
Hỗn hợp T gồm ba este mạch hở X (đơn chức), Y (hai chức), Z (ba chức) đều được tạo thành từ axit cacboxylic có mạch cacbon không phân nhánh và ancol. Đốt cháy hoàn toàn m gam T, thu được H2O và 2,31 mol CO2. Xà phòng hóa hoàn toàn m gam T bằng lượng vừa đủ 930 ml dung dịch NaOH 1M, thu được hỗn hợp F gồm hai muối có cùng số nguyên tử cacbon trong phân tử và 29,16 gam hỗn hợp E gồm hai ancol. Đốt cháy toàn bộ F thu được H2O, Na2CO3 và 0,915 mol CO2. Khối lượng của Z trong m gam T là
 Xem đáp án
Xem đáp án
nCOO = nOH = nNaOH = 0,93 (mol)
Xét phản ứng đốt cháy muối: ® nNa2CO3 = 0,465 (mol) (BTNa)
® nC/muối(F) = nCO2 + nNa2CO3 = 1,38.
® BTC: nC/ancol = nC/T – nC/F = 2,31 – 1,38 = 0,93 = nOH
2 ancol có thể là 2 trong các ancol: CH3OH, C2H4(OH)2, C3H5(OH)3 (không thể có ancol 4 chức do este tối đa 3 chức). ® Mtb(C – OH) = 29,16/0,93 = 31,35 ® phải có CH3OH (M = 32 > 31,35).
TH1: CH3OH: 0,48 mol; C3H5(OH)3: 0,15 mol ® loại vì các este tìm được giải ra nghiệm âm.
TH2: CH3OH: 0,33 (mol); C2H4(OH)2: 0,3 (mol).
Do axit mạch C không phân nhánh nên tối đa có 2 nhóm chức.
2 muối RCOONa: x (mol); R’(COONa)2: y (mol) ® x + 2y = 0,93 ó 0,465 < x + y < 0,93
® 1,38/0,93 < Cax < 1,38/0,465 ó 1,48 < Cax < 2,96 ® do 2 ax cùng C ® Cax = 2
® 2 muối: CH3COONa: x (mol); (COONa)2: y (mol) ® x + 2y = 0,93; BTC: 2x + 2y = 1,38
®x = 0,45; y = 0,24 (mol).
® 3 este: (X) CH3COOCH3: 0,09 mol; (Y) (CH3COO)2C2H4: 0,06 mol;
(Z) CH3COO – C2H4 – OOC – COOCH3: 0,24
® mZ = 0,24. 190 = 45,6 g