(2023) Đề thi thử Hóa THPT Việt Nam- Ba Lan, Hà Nội (Lần 1) có đáp án
(2023) Đề thi thử Hóa THPT Việt Nam- Ba Lan, Hà Nội (Lần 1) có đáp án
-
420 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 3:
Trong tự nhiên, canxi sunfat tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là
 Xem đáp án
Xem đáp án
Chọn D
Câu 5:
Khi cho Na vào dung dịch CuSO4 có hiện tượng:
 Xem đáp án
Xem đáp án
Khi cho Na vào dung dịch CuSO4 có hiện tượng: Có khí bay ra và có kết tủa màu xanh
Na + H2O —> NaOH + H2
NaOH + CuSO4 —> Cu(OH)2 + Na2SO4
Chọn B
Câu 6:
Điện phân NaCl nóng chảy xảy ra phản ứng : 2NaCl → 2Na + Cl2
 Xem đáp án
Xem đáp án
NaCl nóng chảy chức các ion Na+, Cl-, trong đó Na+ di chuyển đến catot và bị khử thành Na, Cl- di chuyển đến anot và bị oxi hóa thành Cl2.
Chọn A
Câu 10:
Chất nào sau đây được dùng để khử chua trong đất nông nghiệp?
 Xem đáp án
Xem đáp án
CaO được dùng để khử chua trong đất nông nghiệp:
CaO + 2H+ —> Ca2+ + H2O
Chọn C
Câu 11:
Phát biểu đúng là:
 Xem đáp án
Xem đáp án
A. Sai, nung nóng đá vôi (CaCO3) sẽ thu được CaO và CO2.
B. Sai, NaOH không loại bỏ được Ca2+ nên không thu được nước mềm.
C. Đúng
D. Sai, Al2O3, Al(OH)3 có tính lưỡng tính. Na2CO3 có tính bazơ, không có tính axit.
Chọn C
Câu 12:
Cho phương trình hóa học sau: Ca(HCO3)2 → CaCO3↓ + CO2 + H2O. Phản ứng này không giải thích được hiện tượng nào dưới đây
 Xem đáp án
Xem đáp án
Phản ứng này không giải thích được hiện tượng sự xâm thực đá vôi của nước mưa.
Sự xâm thực đá vôi của nước mưa là do phản ứng:
CaCO3 + CO2 + H2O —> Ca(HCO3)2
Chọn B
Câu 13:
Nguyên tử Mg có Z = 12, cấu hình electron của Mg là
 Xem đáp án
Xem đáp án
Mg (Z = 12): 1s2 2s2 2p6 3s2.
Chọn A
Câu 15:
Những đặc điểm nào sau đây không là chung cho các kim loại kiềm?
 Xem đáp án
Xem đáp án
Số lớp electron không phải đặc điểm chung. Mỗi kim loại kiềm sẽ có nguyên tử với số lớp electron khác nhau (bằng số thứ tự của chu kỳ).
Chọn B
Câu 16:
Chỉ dùng dung dịch KOH để phân biệt được các chất riêng biệt trong nhóm nào sau đây?
 Xem đáp án
Xem đáp án
Chỉ dùng dung dịch KOH để phân biệt được các chất riêng biệt trong nhóm Mg, Al2O3, Al.
+ Không tan là Mg
+ Tan, không có khí là Al2O3
Al2O3 + KOH —> KAlO2 + H2O
+ Tan, có khí là Al
Al + H2O + KOH —> KAlO2 + H2
Chọn D
Câu 17:
Hình vẽ sau đây mô tả thí nghiệm khi cho khí X tác dụng với chất rắn Y, nung nóng sinh ra khí Z:
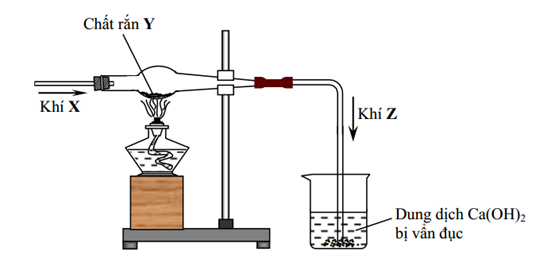
Phương trình hóa học của phản ứng tạo thành khí Z là
 Xem đáp án
Xem đáp án
Khí Z làm đục nước vôi trong —> Z là CO2
HCl dạng khí không phản ứng với CaCO3 nên phản ứng phù hợp là:
CuO + CO → Cu + CO2.
Chọn B
Câu 21:
Cho 2,16 gam Mg tác dụng với dung dịch HNO3 (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít khí NO (ở đktc) và dung dịch X. Khối lượng muối khan thu được khi làm bay hơi dung dịch X là:
 Xem đáp án
Xem đáp án
nMg = 0,09 & nNO = 0,04
—> nNH4NO3 = 0,0075
—> m muối = mMg(NO3)2 + mNH4NO3 = 13,92
Chọn B
Câu 22:
Dẫn chậm 17,6 gam CO2 vào 500 ml dung dịch Ca(OH)2 0,6M. Phản ứng kết thúc thu được bao nhiêu gam kết tủa?
 Xem đáp án
Xem đáp án
nCO2 = 0,4; nCa(OH)2 = 0,3
—> nCaCO3 = 2nCa(OH)2 – nCO2 = 0,2
—> mCaCO3 = 20 gam
Chọn C
Câu 23:
Cho hỗn hợp các kim loại kiềm Na, K hòa tan hết vào nước được dung dịch A và 0,672 lít khí H2 (đktc). Thể tích dung dịch HCl 0,1M cần để trung hòa hết một phần hai dung dịch A là:
 Xem đáp án
Xem đáp án
nH2 = 0,03 —> nOH- = 0,06 —> nHCl = 0,06
—> VddHCl = 600 ml
Chọn D
Câu 24:
Cặp chất không xảy ra phản ứng hóa học là
 Xem đáp án
Xem đáp án
A. Fe + HCl —> FeCl2 + H2
B. Cu + FeCl3 —> CuCl2 + FeCl2
C. Fe + FeCl3 —> FeCl2
D. Không phản ứng
Chọn D
Câu 25:
Muối Fe2(SO4)3 dễ tan trong nước, khi kết tinh thường ở dạng ngậm nước như Fe2(SO4)3.9H2O. Tên gọi của Fe2(SO4)3 là
 Xem đáp án
Xem đáp án
Chọn D
Câu 27:
Cho m gam hỗn hợp X gồm Mg và Al vào dung dịch HCl dư thu được 8,96 lít khí. Mặt khác, cho m gam hỗn hợp X tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí. Thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị của m là:
 Xem đáp án
Xem đáp án
Với NaOH, chỉ Al phản ứng: nH2 = 0,3 —> nAl = 0,2
Với HCl, cả Mg và Al đều phản ứng —> nMg = 0,4 – 0,3 = 0,1
—> m = 7,8 gam
Chọn D
Câu 28:
Cho các cặp kim loại nguyên chất tiếp xúc trực tiếp với nhau: Fe và Sn; Fe và Pb; Fe và Zn; Fe và Ni. Khi nhúng các cặp kim loại trên vào dung dịch axit, số cặp kim loại trong đó Fe bị phá huỷ trước là
 Xem đáp án
Xem đáp án
Có 3 cặp Fe bị phá hủy trước là Fe và Sn; Fe và Pb; Fe và Ni do Fe có tính khử mạnh hơn kim loại còn lại trong cặp.
Chọn C
Câu 29:
Có thể dùng bình bằng Al để chuyên chở các dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Có thể dùng bình bằng Al để chuyên chở dung dịch HNO3 đặc nguội và H2SO4 đặc nguội vì Al bị thụ động trong 2 axit đặc nguội này.
Chọn C
Câu 30:
Cho phản ứng: aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O. Tỉ lệ a : b là
 Xem đáp án
Xem đáp án
Al + 4HNO3 —> Al(NO3)3 + NO + 2H2O
—> a/b = 1/4
Chọn A
Câu 31:
Cho 10 gam hỗn hợp các kim loại Mg và Cu tác dụng hết với dung dịch HCl loãng dư thu được 3,36 lít H2 (đkc). Thành phần % theo khối lượng của Mg trong hỗn hợp là
 Xem đáp án
Xem đáp án
Mg + 2HCl —> MgCl2 + H2
Cu không phản ứng nên nMg = nH2 = 0,15
—> %mMg = 0,15.24/10 = 36%
Chọn C
Câu 32:
Nhôm hidroxit thu được từ cách nào sau đây?
 Xem đáp án
Xem đáp án
A. HCl dư + NaAlO2 —> NaCl + AlCl3 + H2O
B. CO2 + H2O + NaAlO2 —> Al(OH)3 + NaHCO3
C. NaOH dư + AlCl3 —> NaAlO2 + NaCl + H2O
D. Không phản ứng
Chọn B
Câu 34:
Cho 15,6 gam hỗn hợp X gồm Al và Al2O3 tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2 (đktc). Khối lượng của Al2O3 trong X là
 Xem đáp án
Xem đáp án
nH2 = 0,3 —> nAl = 0,2
mAl2O3 = mX – mAl = 10,2 gam
Chọn D
Câu 35:
Cặp chất nào sau đây gây nên tính cứng vĩnh cửu của nước?
 Xem đáp án
Xem đáp án
Cặp chất CaCl2, MgSO4 gây nên tính cứng vĩnh cửu của nước.
Chọn C
Câu 37:
Thực hiện các thí nghiệm sau:
(a) Nung nóng Cu(NO3)2.
(b) Cho Fe(OH)2 vào dung dịch H2SO4 đặc, nóng (dư).
(c) Sục khí CO2 vào dung dịch Ca(OH)2 dư.
(d) Cho dung dịch KHSO4 vào dung dịch NaHCO3.
(e) Cho dung dịch Fe(NO3)2 vào dung dịch HCl loãng.
(g) Cho đinh sắt vào dung dịch H2SO4 loãng.
Sau khi các phản ứng xảy ra, số thí nghiệm sinh ra chất khí là
 Xem đáp án
Xem đáp án
(a) Cu(NO3)2 —> CuO + NO2 + O2
(b) Fe(OH)2 + H2SO4 —> Fe2(SO4)3 + SO2 + H2O
(c) CO2 + Ca(OH)2 —> CaCO3 + H2O
(d) KHSO4 + NaHCO3 —> K2SO4 + Na2SO4 + CO2 + H2O
(e) Fe2+ + H+ + NO3- —> Fe3+ + NO + H2O
(g) Fe + H2SO4 —> FeSO4 + H2
Chọn B
Câu 38:
Để m gam hỗn hợp E gồm Al, Fe và Cu trong không khí một thời gian, thu được 34,4 gam hỗn hợp X gồm các kim loại và oxit của chúng. Cho 6,72 lít khí CO qua X nung nóng, thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với H2 là 18. Hòa tan hoàn toàn Y trong dung dịch chứa 1,7 mol HNO3, thu được dung dịch chỉ chứa 117,46 gam muối và 4,48 lít hỗn hợp khí T gồm NO và N2O. Tỉ khối của T so với H2 là 16,75. Giá trị của m là
 Xem đáp án
Xem đáp án
Z gồm CO2 (0,15) và CO dư (0,15)
X gồm kim loại (m gam) và O (a mol)
Y gồm kim loại (m gam) và O (a – 0,15 mol)
mX = m + 16a = 34,4 (1)
T gồm NO (0,15) và N2O (0,05). Đặt nNH4+ = b
nH+ = 1,7 = 0,15.4 + 0,05.10 + 10b + 2(a – 0,15) (2)
m muối = m + 62(0,15.3 + 0,05.8 + 8b + 2(a – 0,15)) + 80b = 117,46 (3)
(1)(2)(3) —> a = 0,4; b = 0,01; m = 28
Chọn D
Câu 39:
Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp chất rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2 (đktc). Sục khí CO2 dư vào Y thu được 8,58 gam kết tủa. Cho Z tan hết vào H2SO4 đặc, nóng thu được dung dịch chứa 20,76 gam muối sunfat và 3,472 lít khí SO2 (đktc). Biết SO2 làn sản phẩm khử duy nhất của S+6, các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Bảo toàn Al —> nAl ban đầu = nAl(OH)3 = 0,11
Bảo toàn electron: 3nAl = 2nO + 2nH2
—> nO = 0,135
nSO2 = 0,155 —> mFe = 20,76 – 0,155.96 = 5,88
m = mFe + mO = 8,04
Chọn B
Câu 40:
Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K2O, Ba và BaO (trong đó oxi chiếm 10% về khối lượng) vào nước, thu được 300 ml dung dịch Y và 0,336 lít khí H2. Trộn 300 ml dung dịch Y với 200 ml dung dịch gồm HCl 0,2M và HNO3 0,3M, thu được 500 ml dung dịch có pH = 13. Giá trị của m là
 Xem đáp án
Xem đáp án
nHCl = 0,04 và nHNO3 = 0,06 —> nH+ = 0,1
pH = 13 —> [OH-] dư = 0,1 —> nOH- dư = 0,05
—> nOH- trong Y = 0,1 + 0,05 = 0,15
nOH- = 2nH2 + 2nO —> nO = 0,06
—> mX = 0,06.16/10% = 9,6 gam
Chọn B
