(2024) Đề minh họa tham khảo BGD môn Hóa có đáp án (8)
-
85 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Chất nào sau đây phản ứng với dung dịch AgNO3 trong NH3 tạo kết tủa vàng?
 Xem đáp án
Xem đáp án
Chất phản ứng với AgNO3/NH3 tạo kết tủa vàng phải có liên kết ba đầu mạch
→ Propin: CH≡C-CH3
Câu 2:
Trong hợp chất nào sau đây, Crom có số oxi hóa +6?
 Xem đáp án
Xem đáp án
A. NaCrO2: số oxi hóa của crom là +3
B. Cr2(SO4)3: số oxi hóa của crom là +3
C. Na2Cr2O7: số oxi hóa của crom là +6
D. Cr(OH)2: số oxi hóa của crom là +2
Câu 3:
Thạch cao nung là một hợp chất của canxi, có nhiều ứng dụng trong đời sống như đúc tượng, bó bột khi gãy xương, làm phấn viết bảng…Công thức của thạch cao nung là
 Xem đáp án
Xem đáp án
Thạch cao nung: CaSO4.H2O
Câu 7:
Trong peptit Gly – Ala-Val-Glu, amino axit đầu N là
 Xem đáp án
Xem đáp án
Amino axit đầu N là amino axit còn chứa nhóm –NH2 → Gly
Câu 8:
Chất nào sau đây là đisaccarit?
 Xem đáp án
Xem đáp án
Saccarozo: đisaccarit
Xenlulozo, tinh bột: polisaccarit
Glucozo: monosaccarit
Câu 9:
Kim loại sắt tác dụng với lượng dư dung dịch chất nào sau đây tạo thành muối sắt(III)?
 Xem đáp án
Xem đáp án
Fe tác dụng với các axit HNO3, H2SO4 đặc, nóng, dư sẽ tạo muối sắt (III) (chú ý HNO3, HSO4 đặc, nguội không tác dụng với Fe)
Câu 10:
Kim loại nào sau đây tác dụng với nước ở nhiệt độ thường giải phóng khí H2?
 Xem đáp án
Xem đáp án
Các kim loại K, Na, Ca, Ba,...thường dễ tác dụng với H2O tạo dung dịch bazơ và giải phóng khí H2
Câu 11:
Khi đốt rơm rạ trên các cánh đồng sau những vụ thu hoạch lúa sinh ra nhiều khói bụi, trong đó có khí X. Khí X nặng hơn không khí và gây hiệu ứng nhà kính. Khí X là
 Xem đáp án
Xem đáp án
Câu 12:
Cách bảo vệ kim loại nào sau đây là phương pháp bảo vệ điện hóa?
 Xem đáp án
Xem đáp án
Khi nối Zn với thép (thành phần chính là Fe) thì Zn sẽ bị ăn mòn trước, lớp vỏ tàu bằng théo sẽ được bào vệ
Câu 13:
Chất nào sau đây thuộc loại ancol no, đơn chức, mạch hở?
 Xem đáp án
Xem đáp án
Ancol no, đơn chức, mạch hở có công thức chung là CnH2n+1OH
Câu 14:
Natri hiđrocacbonat là chất rắn màu trắng, ít tan trong nước, dễ bị phân hủy. Natri hiđrocacbonat có công thức là
 Xem đáp án
Xem đáp án
Natri hiđrocacbonat là NaHCO3
Câu 15:
Nhôm oxit tác dụng với dung dịch NaOH thu được sản phẩm X, tan được trong nước.Tên gọi của X là?
 Xem đáp án
Xem đáp án
Al2O3 + 2NaOH → 2NaAlO2 + H2O
(natri aluminat)
Câu 17:
Chất nào sau đây có thể làm mềm nước cứng vĩnh cữu?
 Xem đáp án
Xem đáp án
Nước cứng vĩnh cửu có thể làm mềm bằng Na3PO4.
3Ca2+ + 2PO43- → Ca3(PO4)2 $
3Mg2+ + 2PO43- → Mg3(PO4)2 $
Câu 18:
Al có khả năng khử được oxit nào dưới đây thành kim loại?
 Xem đáp án
Xem đáp án
Al có khả năng khử đi oxit kim loại sau Al trong dãy hoạt động hóa học (phản ứng nhiệt nhôm)
Câu 19:
Chất nào sau đây là amin bậc 3?
 Xem đáp án
Xem đáp án
Câu 20:
Số nguyên tử cacbon trong phân tử tristearin là
 Xem đáp án
Xem đáp án
Tristearin có công thức (C17H35COO)3C3H5
Câu 21:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
C sai vì Fe2+ vừa có tính oxi hóa, vừa có tính khử
Câu 22:
Thủy phân hoàn toàn m gam tinh bột thành glucozơ, Cho toàn bộ glucozơ tham gia phản ứng tráng bạc (hiệu suất 80%), thu được 21,6 gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
(C6H10O5)n → nC6H12O6 → n2Ag
0,1 ←0,2 mol
mtb = 0,1.162 : 0,8 = 20,25 gam
Câu 23:
Hiđro hóa hoàn toàn m gam triolein cần vừa đủ 13,44 lít khí H2 (đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
(C17H33COO)3C3H5 + 3H2 → (C17H35COO)3C3H5
0,02 ←0,06
→ mtriolein = 0,02.884 = 17,68 gam
Câu 24:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A sai vì trong máu chứa khoảng 0,1% glucozơ
B sai vì tinh bột không tan trong dung dịch nước Svayde
D sai vì gồm glucozơ và fructozơ
Câu 25:
Cho dãy các chất: HCl, CuSO4, FeCl2, KNO3. Số chất trong dãy phản ứng được với dung dịch NaOH là
 Xem đáp án
Xem đáp án
NaOH tác dụng được với HCl, CuSO4, FeCl2
Câu 26:
Cho 3 gam kim loại M hóa trị 2 tác dụng với dung dịch H2SO4 loãng, vừa đủ, sau phản ứng thu được 15 gam muối sunfat trung hòa. Kim loại M là
 Xem đáp án
Xem đáp án
M + H2SO4 → MSO4 + H2
M M+96
3 (g) 15 (g)
→ M = 24 (Mg)
Câu 27:
Cho 7,788 gam amin X (no, đơn chức, mạch hở) tác dụng hết với dung dịch HCl dư, thu được 12,606 gam muối. Số nguyên tử H trong phân tử X là
 Xem đáp án
Xem đáp án
RNH2 + HCl → RNH3Cl
→ R = 43(C3H7) → CT amin: C3H7NH2
→ Số nguyên tử H là 9
Câu 28:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
B sai vì tạo ra từ phản ứng trùng hợp
C sai vì tạo ra từ phản ứng trùng ngưng
D sai vì là bán tổng hợp
Câu 29:
Hòa tan hết 9,6 gam Cu trong dung dịch H2SO4 đặc, nóng thu được V lít khí SO2 (đktc, sản phẩm khử duy nhất). Giá trị của V là
 Xem đáp án
Xem đáp án
Cu + H2SO4 → CuSO4 + SO2 + H2O
0,15mol → 0,15
VSO2 = 0,15.22,4 = 3,36 lít
Câu 30:
Cho sơ đồ sau: C2H2 → X → Y → Z → CH3COOC2H5
Các chất X, Y, Z tương ứng là
 Xem đáp án
Xem đáp án
C2H2 + H2O → CH3CHO
CH3CHO + H2 → C2H5OH
C2H5OH + O2 → CH3COOH + H2O
CH3COOH + C2H5OH CH3COOC2H5 + H2O
Câu 31:
Cho hai chất hữu cơ mạch hở E, F có cùng công thức đơn giản nhất là C3H4O2. Các chất E, F, X, Z tham gia phản ứng theo đúng tỉ lệ mol như sơ đồ dưới đây:
(1) E + NaOH X + Y (2) F + NaOH Z + T
(3) X + HCl J + NaCl (4) Z + HCl G + NaCl
Biết: X, Y, Z, T, J, G là các chất hữu cơ trong đó T đa chức và ME < MF < 146. Cho các phát biểu sau:
(a) F là hợp chất hữu cơ đa chức.
(b) 1 mol J khi tham gia phản ứng tráng gương (AgNO3/NH3) thu được 4 mol Ag.
(c) Đốt cháy T thu được số mol CO2 lớn hơn số mol H2O.
(d) Z có khả năng làm mất màu dung dịch brom.
(e) G là axit không no, đơn chức.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
ME < MF < 146 và E, F có cùng công thức đơn giản nhất là C3H4O2 E là C3H4O2 và F là C6H8O4
E + NaOH tạo 2 sản phẩm hữu cơ nên E là HCOOCH=CH2
X là HCOONa; Y là CH3CHO và J là HCOOH
F tác dụng với NaOH theo tỉ lệ mol 1 : 1 và tạo 2 sản phẩm hữu cơ nên F chứa 1 chức este.
T là chất hữu cơ đa chức nên F là CH=CH-COO-CH2-CHOH-CH2OH Z là CH C-COONa và T là C3H5(OH)3
(a) Sai vì F là CH=CH-COO-CH2-CHOH-CH2OH → F là hợp chất hữu cơ tạp chức.
(b) Sai vì J là HCOOH khi tráng gương thu được 2 mol Ag.
(c) Sai vì T là C3H5(OH)3 (ancol no, mạch hở), khi đốt cháy thu được số mol H2O > số mol CO2
(d) Đúng vì Z là CH C-COONa có chứa liên kết ba nên có khả năng làm mất màu dung dịch Brom.
(e) Đúng vì G là CH C-COOH → axit không no, đơn chức.
Câu 32:
Cho 10,1 gam hỗn hợp gồm Na, Na2O, K2O vào H2O dư, thu được 100 ml dung dịch X và V lít H2 (đktc). Cho 100 ml dung dịch HCl 2,8M vào 100ml dung dịch X đến khi phản ứng hoàn toàn thu được 200 ml dung dịch Y có pH = 13. Cô cạn Y thu được 18,78 gam chất rắn khan. Giá trị của V là
 Xem đáp án
Xem đáp án
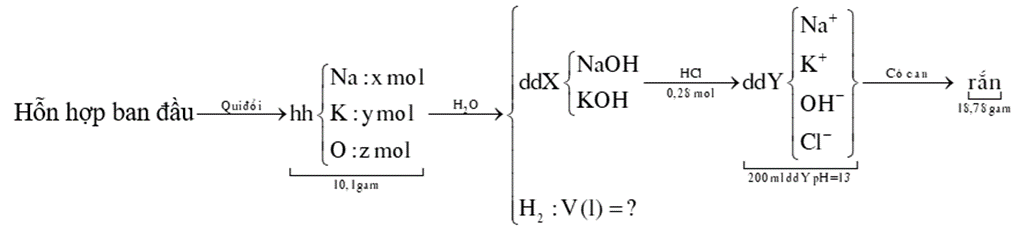
Câu 33:
Tiến hành thí nghiệm phản ứng của hồ tinh bột với iot theo các bước sau đây:
- Bước 1: Cho vài giọt dung dịch iot vào ống nghiệm đựng sẵn 2 ml dung dịch hồ tinh bột.
- Bước 2: Đun nóng dung dịch một lát, sau đó để nguội.
Cho các phát biểu sau:
(1) Sau bước 1, dung dịch thu được có màu tím.
(2) Tinh bột có phản ứng màu với iot vì phân tử tinh bột có cấu tạo mạch hở ở dạng xoắn có lỗ rỗng, tinh bột hấp phụ iot cho màu xanh tím.
(3) Ở bước 2, khi đun nóng dung dịch, các phân tử iot được giải phóng khỏi các lỗ rỗng trong phân tử tinh bột nên dung dịch bị mất màu. Để nguội, màu xanh tím lại xuất hiện.
(4) Có thể dùng dung dịch iot để phân biệt hai dung dịch riêng biệt gồm hồ tinh bột và saccarozơ.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(1) Đúng: Sau bước 1, I2 làm tinh bột chuyển màu xanh tím
(2) Đúng: Tinh bột có phản ứng màu với iot vì phân tử tinh bột có cấu tạo mạch hở ở dạng xoắn có lỗ rỗng, tinh bột hấp phụ iot cho màu xanh tím.
(3) Đúng: Ở bước 2, khi đun nóng dung dịch, các phân tử iot được giải phóng khỏi các lỗ rỗng trong phân tử tinh bột nên dung dịch bị mất màu. Để nguội, màu xanh tím lại xuất hiện.
(4) Đúng: I2 làm tinh bột chuyển màu xanh tím, còn saccarozo không có phản ứng.
Câu 34:
Hỗn hợp X gồm Fe2O3, CuO, Cu, Fe. Hòa tan hết 14,56 gam X trong 200 gam dung dịch HCl 8,03%, thu được 1,344 lít khí H2 và dung dịch Y chỉ chứa muối. Mặt khác, nếu hòa tan hết 14,56 gam X vào dung dịch H2SO4 (đặc, nóng), thu được dung dịch E (chỉ chứa các muối trung hòa) và 2,016 lít khí SO2 (sản phẩm khử duy nhất của S+6,). Cho E tác dụng với dung dịch Ba(OH)2 dư, thu được kết tủa F. Nung F trong không khí đến khối lượng không đổi, thu được 74,25 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn, thể tích khí đo ở đktc. Nồng độ phần trăm của muối CuCl2 trong Y là
 Xem đáp án
Xem đáp án
\({n_{HCl}} = \frac{{200.8,03}}{{100.36,5}} = 0,44\,mol\); \({n_{{H_2}}} = 0,06\,mol\)
Bảo toàn H: nHCl = 2nH2 + 2nH2O
→ nO = nH2O = 0,16 mol
Y chứa CuCl2 (a), FeCl2 (b), FeCl3 (c)
mX = 64a + 56(b + c) + 0,16.16 = 14,56 (1)
nHCl =\({n_{C{l^ - }}}\)= 2a + 2b + 3c = 0,44 (2)
nSO2 = 0,09 mol
nH2SO4 = 2nSO2 + nO = 0,34 mol
Bảo toàn S → \({n_{BaS{O_4}}} = {n_{SO_4^{2 - }\,\,(E)}} = {n_{{H_2}S{O_4}}} - {n_{S{O_2}}} = 0,34 - 0,09 = 0,25\,mol\)
mrắn = \({m_{BaS{O_4}}} + {m_{CuO}} + {m_{F{e_2}{O_3}}} = 0,25.233 + 80a + 160.\frac{{b + c}}{2}\)= 74,25 (3)
(1)(2)(3) → a = 0,1 mol; b = 0,06 mol; c = 0,04 mol
mddY = mX + mddHCl – mH2 = 214,44 gam
→ \(C{\% _{CuC{l_2}}} = \frac{{0,1.135}}{{214,44}}.100 = 6,30\% \)
Câu 35:
Hỗn hợp T gồm ba este X, Y, Z mạch hở (MX < MY < MZ). Cho 28,35 gam T tác dụng vừa đủ với dung dịch chứa 0,375 mol NaOH, thu được một muối duy nhất của axit cacboxylic đơn chức và hỗn hợp Q gồm các ancol no, mạch hở, có cùng số nguyên tử cacbon trong phân tử. Đốt cháy hoàn toàn Q, thu được 10,08 lít khí CO2 (đktc) và 10,8 gam H2O. Khối lượng phân tử của este Y là
 Xem đáp án
Xem đáp án
nNaOH = nOH = nRCOONa = 0,375 mol
⇒ X: CH3COOC3H7
Y: (CH3COO)2C3H6 → MY = 160
Z: (CH3COO)3C3H5
Câu 36:
Cho các phát biểu sau:
(a) Đốt cháy este no, đơn chức mạch hở thì thu được số mol CO2 lớn hơn số mol H2O.
(b) Trùng hợp axit terephtalic với etylen glicol thu được tơ lapsan.
(c) Dung dịch alanin làm quỳ tím hóa xanh.
(d) Peptit Gly-Ala-Gly-Glu chứa 7 nguyên tử oxi.
(e) Amilopectin có cấu trúc mạch phân nhánh.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai vì đốt cháy este no, đơn chức mạch hở thì thu được số mol CO2 = số mol H2O.
(b) Sai vì đây là phản ứng trùng ngưng.
(c) Sai vì alanin NH2-CH(CH3)-COOH có môi trường trung tính do có 1 nhóm NH2 và nhóm COOH
(d) Đúng
CTCT của peptit: NH2-CH2-CO-NH-CH(CH3)-CO-NH-CH2-CO-NH-C3H5-(COOH)
→ có chứa 7 nguyên tử oxi.
(e) Đúng
Câu 37:
Hòa tan vừa hết m gam hỗn hợp X gồm S và P vào dung dịch HNO3 đặc nóng, thu được dung dịch Y và khí NO2 là sản phẩm khử duy nhất. Cho Y vào dung dịch Z chứa hỗn hợp 0,05 mol NaOH và 0,35 mol KOH, thu được dung dịch T có chứa 29,1 gam bốn muối trung hòa. Giá trị của m là
 Xem đáp án
Xem đáp án
nS = a và nP = b → T chứa 4 muối trung hòa gồm các ion SO42- (a), PO43- (b), Na+ (0,05) và K+ (0,35)
Bảo toàn điện tích: 2a + 3b = 0,05 + 0,35
mmuối = 96a + 95b + 0,05.23 + 0,35.39 = 29,1
→ a = 0,05; b = 0,1
→ m = 32a + 31b = 32.0,05+31.0,1 = 5,5 (g)
Câu 38:
Điện phân dung dịch 400ml dung dịch X chứa AgNO3 và 0,1 mol NaCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi, hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch, toàn bộ kim loại sinh ra bám vào catot). Thể tích khí thu được trong quá trình điện phân (ở cả hai điện cực) theo thời gian điện phân như sau:
|
Thời gian điện phân |
t giây |
2t giây |
3t giây |
|
Thể tích khí đo ở đktc |
0,896 lít |
1,456 lít |
2,464 lít |
Nồng độ mol/l của AgNO3 trong dung dịch X là
 Xem đáp án
Xem đáp án
\[\begin{array}{l} + \,\,Ta\"i i\,\,th\^o {\o}i\,\,\~n ie{\aa}m\,\,t\,\,gia\^a y:\,\,{n_{C{l_2}}} = 0,04 \to {n_{elcctron\,\,trao\,\,\~n o{\aa}i}} = 0,08.\\ + \,\,\left\{ \begin{array}{l}Ta\"i i\,\,th\^o {\o}i\,\,\~n ie{\aa}m\,\,2t\,\,gia\^a y\\{n_{elcctron\,\,trao\,\,\~n o{\aa}i}} = 0,08.2 = 0,16\end{array} \right. \to \left\{ \begin{array}{l}{n_{ho\~a n\,\,h\^o \"i p\,\,kh\'i }} = {n_{C{l_2}}} + {n_{{O_2}}} = 0,065\\BTE:\,\,2{n_{C{l_2}}} + 4{n_{{O_2}}} = 0,16\,\end{array} \right. \to \left\{ \begin{array}{l}{n_{C{l_2}}} = 0,05\\{n_{{O_2}}} = 0,015\end{array} \right.\\ + \,\,\left\{ \begin{array}{l}Ta\"i i\,\,th\^o {\o}i\,\,\~n ie{\aa}m\,\,3t\,\,gia\^a y\\{n_{elcctron\,\,trao\,\,\~n o{\aa}i}} = 0,08.3 = 0,24\end{array} \right. \to \left\{ \begin{array}{l}\^O \^U \,\,\,anot:\,\,2\underbrace {{n_{C{l_2}}}}_{0,05} + 4{n_{{O_2}}} = 0,24\\{n_{ho\~a n\,\,h\^o \"i p\,\,kh\'i }} = {n_{{H_2}}} + {n_{C{l_2}}} + {n_{{O_2}}} = 0,11\end{array} \right. \to \left\{ \begin{array}{l}{n_{{O_2}}} = 0,035\\{n_{{H_2}}} = 0,025\end{array} \right.\end{array}\]
BT e ở catot khi thời gian điện phân là 3t: \({n_{Ag}}.1 + 2.{n_{{H_2}}} = 0,24 \Rightarrow {n_{Ag}} = 0,19\,mol\)
\(C{\% _{CuC{l_2}}} = \frac{{0,1.135}}{{214,44}}.100 = 6,30\% \)
Câu 39:
Cho 32 gam bột CuO tan vừa hết trong dung dịch H2SO4 25%, sau đó làm nguội dung dịch đến 10oC, thấy khối lượng tinh thể CuSO4.5H2O bị tách ra khỏi dung dịch là m gam. Biết độ tan của CuSO4 ở 10oC là 17,4 gam. Giá trị gần nhất của m là

 Xem đáp án
Xem đáp án
n CuSO4.5H2O = a mol
n H2SO4 = CuO = 0,4 mol => m dd H2SO4= 0,4.98 : 25% = 156,8 gam
=> m dung dịch CuSO4 = (32 + 156,8 – 250a) gam
=>C% dd CuSO4 bão hòa ở 10 độ C = \[\frac{{160.(0,4 - a)}}{{188,8 - 250a}} = \frac{{17,4}}{{17,4 + 100}} \Rightarrow a = 0,293mol\]
=> m CuSO4.5H2O \[ \approx \]73,25 gam.
Câu 40:
Xăng E5 là một loại xăng sinh học, được tạo thành khi trộn 5 thể tích etanol (cồn) với 95 thể tích xăng A92. Một loại xăng E5 có tỉ lệ số mol như sau: 5% etanol, 45% heptan, 50% octan. Khi được đốt cháy hoàn toàn, 1 mol etanol sinh ra một lượng năng lượng là 1367kJ, 1 mol heptan sinh ra một lượng năng lượng là 4825 kJ và 1 mol octan sinh ra một lượng năng lượng là 5460 kJ, năng lượng giải phóng ra có 20% thải vào môi trường, các phản ứng xảy ra hoàn toàn. Một xe máy chạy 1 giờ cần một năng lượng là 20650 kJ, khối lượng riêng của loại xăng E5 này là 750 kg/m3. Thể tích xăng E5 mà xe máy trên đã tiêu thụ trong một giờ là

 Xem đáp án
Xem đáp án
\[{n_{{C_2}{H_5}OH}}{\rm{ }} = {\rm{ }}0,05x;{\rm{ }}{n_{{C_7}{H_{16}}}} = {\rm{ }}0,45x;{\rm{ }}{n_{{C_8}{H_{18}}}} = {\rm{ }}0,5x\]
Có 20% năng lượng thải vào môi trường nên có 80% năng lượng sinh công.
\(\begin{array}{l}Q = 0,05x.1367 + 0,45x.4825 + 0,5x.5460 = 20650.\frac{{100}}{{80}}\\ \Rightarrow x = 5,194mol\end{array}\)
→ mxăng E5 = 0,05.5,194.46 + 0,45.5,194.100+0,5.5,194.114 = 541,7342 (g)
→ Vxăng E5 = \(\frac{{541,7342}}{{750}} = 0,72\,lit\)
