25 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án
25 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề 8)
-
4687 lượt thi
-
40 câu hỏi
-
90 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án C
Tính chất chung của kim loại là tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim do các electron tự do trong mạng tinh thể gây ra.
Câu 2:
 Xem đáp án
Xem đáp án
Điều chế kim loại kiềm thổ bằng cách điện phân nóng chảy muối halogen của kim loại kiềm thổ.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án B
PTHH:
Câu 4:
Khi xà phòng hóa tristearin bằng dung dịch NaOH ta thu được sản phẩm là
 Xem đáp án
Xem đáp án
Đáp án D
PTHH:
Câu 5:
Khi nghiền clanhke, người ta trộn thêm 5 – 10% chất X để điều chỉnh tốc độ đông cứng của xi măng. Chất X là
 Xem đáp án
Xem đáp án
Đáp án A
Trong xi măng chứa 5-10% thạch cao (CaSO4) đề điều chỉnh tốc độ đông cứng của xi măng.
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án D
Amino axit là hợp chất hữu cơ tạp chức mà trong phân tử chứa đồng thời nhóm amino và nhóm cacboxyl
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án C
Axit nitric tác dụng hầu hết với các kim loại trừ Au, Pt.
|
Kim loại tác dụng với axit: - HCl, H2SO4 loãng: Những kim loại đứng trước H trong dãy điện hóa kim loại. - H2SO4 đặc, HNO3 loãng, HNO3 đặc: Hầu hết các kim loại trừ Au, Pt. - Đặc biệt, Fe, Al, Cr không tác dụng với HNO3, H2SO4 đặc nguội. - Au tan trong nước cường toan là dung dịch gồm HCl và HNO3 với tỉ lệ tương lệ tương ứng về số mol là 3:1. |
Câu 9:
Tơ nitron dai, bền với nhiệt, giữ nhiệt tốt, thường được dùng để dệt vải và may quần áo ấm. Tơ nitron (hay olon) được điều chế bằng phương pháp trùng hợp từ monome nào sau đây?
 Xem đáp án
Xem đáp án
Câu 10:
 Xem đáp án
Xem đáp án
Những kim loại đứng sau Al trong dãy hoạt động hóa học được điều chế bằng phương pháp nhiệt luyện.
Câu 11:
 Xem đáp án
Xem đáp án
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án C
PTHH:
|
Ancol tác dụng được với những chất sau: - Kim loại kiềm. - Oxi hóa hoàn toàn (cháy trong O2) - Oxi hóa không hoàn toàn bởi CuO tạo anđehit (ancol bậc 1), tạo xeton (ancol bậc 2), ancol bậc 3 không bị oxi hóa. - Phản ứng với axit vô cơ (HCl), axit hữu cơ tạo este. - Phản ứng hiđrat hóa (tách nước tạo anken hoặc ete tùy điều kiện phản ứng). |
Câu 13:
Hòa tan hoàn toàn m gam Fe vào dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Ta có:
0,2 0,2 0,1
Bte:
Nên
Vậy
Câu 14:
Trong một cốc nước cứng có chứa 0,02 mol , 0,02 mol , 0,04 mol , 0,04 mol và x mol Giá trị của x là
 Xem đáp án
Xem đáp án
Đáp án B
BTĐT:
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án D
- Chất không làm quỳ tím đổi màu: anilin, ancol etylic.
- Chất làm quỳ tím ẩm hóa xanh: metyl amin.
- Chất làm quỳ tím hóa đỏ: axit axetic.
|
Quỳ tím làm chất chỉ thị nhận biết chất hữu cơ: - Quỳ tím hóa xanh: amin trừ amin thơm (anilin), amino axit có tính ba zơ mạnh hơn tính axit. - Quỳ tím hóa đỏ: axit hữu cơ. - Quỳ tím không đổi màu: phenol, ancol, este, anđehit,… |
Câu 16:
Lên men cho 10 kg glucozơ (chứa 20% tạp chất), biết rằng hiệu suất phản ứng là 90% và khối lượng riêng ancol nguyên chất là 0,8g/ml. Thể tích dung dịch ancol là
 Xem đáp án
Xem đáp án
Đáp án D
: độ rượu.
: khối lượng riêng của ancol nguyên chất.
Câu 17:
aminoaxit X chứa một nhóm Cho 10,3 gam X tác dụng với HCl dư thu được 13,95 gam muối khan. Công thức cấu tạo thu gọn của X là
 Xem đáp án
Xem đáp án
Đáp án A
X là CH3CH2CH(NH2)COOH.
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án A
Glucozơ là chất kết tinh, không màu, tan tốt trong nước; thể hiện tính chất của poliancol, tính chất của anđehit.
Câu 21:
Trường hợp nào sau đây kim loại bị oxi hóa?
 Xem đáp án
Xem đáp án
Đáp án A
Fe bị Cl2 oxi hóa thành FeCl3. Các trường hợp còn lại không xảy ra phản ứng.
Câu 22:
Thực hiện phản ứng este hóa giữa axit acrylic với ancol metylic có mặt H2SO4 làm xúc tác, thu được este X có CTCT thu gọn là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 23:
Phát biểu không đúng là
 Xem đáp án
Xem đáp án
Đáp án A
A sai vì axit axetic mạnh hơn H2CO3 nên CO2 không thể phản ứng với muối CH3COONa.
Câu 24:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án B
A và D sai vì những phản ứng này không phải phản ứng oxi hóa khử.
C sai vì Crom (III) oxit không phản ứng với ancol etylic khi đun nóng, mà là Crom (IV) oxit.
Câu 25:
Hòa tan hết hỗn hợp 2 kim loại kiềm thổ ở 2 chu kì liên tiếp nhau bằng lượng dư dung dịch HCl thu được 25,35 gam hỗn hợp 2 muối và 5,6 lít khí (đktc). Hai kim loại kiềm thổ là
 Xem đáp án
Xem đáp án
Đáp án B
Vậy 2 kim loại là Mg và Ca.
Câu 26:
Thủy phân hoàn toàn chất béo X trong dung dịch NaOH, thu được glixerol và hai muối gồm natri oleat và natri linoleat. Đốt cháy hoàn toàn m gam X, thu được H2O và 275,88 gam CO2. Mặt khác, m gam X tác dụng tối đa với 88 gam brom trong dung dịch. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Este X:
( k1 là số liên kết giữa C và C)
Câu 27:
(a) Chất béo là trieste của glixerol với các axit béo.
(b) Chất béo chứa chủ yếu các gốc no của axit béo thường là chất lỏng ở nhiệt độ phòng và được gọi là dầu.
(c) Thủy phân chất béo trong môi trường kiềm gọi là phản ứng xà phòng hóa.
 Xem đáp án
Xem đáp án
Đáp án A
(b) sai vì chất béo chứa gốc axit béo no là chất rắn, còn chất béo chứa gốc axit béo không no thường là chất lỏng ở nhiệt độ phòng và được gọi là dầu.
Câu 28:
Cho hỗn hợp X gồm Fe2O3, ZnO và Cu tác dụng với dung dịch HCl (dư) thu được dung dịch Y và phần không tan Z. Cho Y tác dụng với dung dịch NaOH (loãng, dư) thu được kết tủa là
 Xem đáp án
Xem đáp án
Đáp án D
Vì X chứa Cu nên trong Y không thể có ion
Kết tủa Zn(OH)2 tan tiếp trong NaOH dư.
|
Đối với bài tập dạng này, không nhất thiết phải viết phương trình phản ứng, chỉ cần xác định ion tồn tại trong dung dịch Y một cách chính xác. Để xác định được ion trong dung dịch Y cần thuộc dãy điện hóa của kim loại để biết chắc nếu tồn tại kim loại này thì sẽ không tồn tại ion nào. |
Câu 29:
Cho 7,68 gam hỗn hợp Fe2O3 và Cu tác dụng với HCl dư, sau phản ứng còn lại 3,2 gam Cu. Khối lượng của Fe2O3 ban đầu là
 Xem đáp án
Xem đáp án
Đáp án B
Ta có:
BTDT:
Từ (1) và (2)
|
Đối với dạng bài toán này, học sinh thường mắc sai lầm với cách hiểu sau đây: Khối lượng Cu là 3,2 gam. Cu không phản ứng với HCl, chỉ có Fe2O3 phản ứng nên:
Cách làm này sai vì Cu không tác dụng với HCl nhưng Cu tác dụng với FeCl3 tạo thành phản ứng Fe2O3 với HCl.
|
Câu 30:
Hỗn hợp khí X gồm 1 anken và 1 ankin có cùng số nguyên tử cacbon trong phân tử. Hỗn hợp X có khối lượng 12,4 và thể tích 6,72 lít (đktc). Thể tích và công thức phân tử lần lượt của ankin và anken là
 Xem đáp án
Xem đáp án
Đáp án D
X:
Câu 31:
Cho m gam X gồm Na, Na2O, Al, Al2O3 vào nước dư thấy tan hoàn toàn, thu được dung dịch Y chứa một chất tan và thấy thoát ra 4,48 lít khí H2 (đktc). Sục khí CO2 dư vào dung dịch Y, thu được 15,6 gam chất rắn X. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
Dung dịch chỉ chứa 1 chất tan là NaAlO2
Bte:
Câu 32:
Cho các phát biểu sau:
(1) Đốt cháy bất kỳ một amin, luôn thu được nitơ đơn chất.
(2) Ở điều kiện thường, đimetylamin là chất khí, tan tốt trong nước.
(3) Nhỏ nước Br2 vào dung dịch alanin, xuất hiện kết tủa trắng.
(4) Dung dịch anilin không làm đổi màu phenolphtalein.
(5) Propan-2-amin là amin bậc 2.
(6) Các peptit đều tham gia phản ứng màu biurê.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Những phát biểu đúng: (1), (2), (4).
(3) Alanin không tác dụng với nước Br2.
(4) Mặc dù anilin có tính bazơ nhưng lực bazơ yếu nên không làm đổi màu chỉ thị.
(5) Propan-2-amin là amin bậc 1 (CH3CH(NH2)CH3)
(6) Peptit có từ 2 liên kết (tripeptit) trở lên mới tham gia phản ứng màu biurê.
Câu 33:
Tiến hành điện phân dung dịch chứa 0,6 mol Cu(NO3)2 và 0,4 mol HCl với điện cực trơ, màng ngăn xốp đến khi khối lượng dung dịch giảm 43,0 gam thì dừng điện phân. Cho m gam bộ Fe vào dung dịch sau điện phân, sau khi kết thúc phản ứng thấy thoát ra khí NO (sản phẩm khử duy nhất của ); đồng thời còn lại 0,5m gam chất rắn không tan. Các khí sinh ra không tan trong dung dịch và hiệu suất quá trình điện phân đạt 100%. Giá trị m là
 Xem đáp án
Xem đáp án
Đáp án C
Cho bột Fe vào dung dịch sau điện phân thấy thoát ra khí NO nên dung dịch sau điện phân chứa đã điện phân hết.
Khối lượng dung dịch giảm 43,0 gam là khối lượng kim loại tạo thành và khối lượng khí thoát ra. Nếu điện phân hết thì khối lượng dung dịch giảm sẽ lớn hơn 43,0 gam, chứng tỏ: chưa điện phân hết.
Vậy dung dịch sau điện phân chứa:
Thứ tự điện phân
Bte:
Vậy số mol trong dung dịch sau điện phân: 0,8 mol.
Chất rắn còn lại, chứng tỏ, muối tạo thành là muối sắt (II).
nên dư, hết
BT e:
Khối lượng kim loại giảm chính là khối lượng Fe tan nhiều hơn khối lượng Cu tạo thành.
Câu 34:
Hai chất hữu cơ X và Y đều mạch hở, chỉ chứa một loại nhóm chức, thành phần nguyên tố đều gồm C, H, O Khi đốt cháy hoàn toàn a mol X cũng như a mol Y đều thu được số mol CO2 nhiều hơn số mol H2O là a mol. Đun nóng 0,2 mol hỗn hợp E chứa X, Y với lượng dư dung dịch AgNO3/NH3, thu được 51,84 gam Ag và dung dịch Z có chứa một muối amoni của axit hữu cơ duy nhất có khối lượng 24,8 gam. Phần trăm khối lượng của Y trong hỗn hợp E là
 Xem đáp án
Xem đáp án
Đáp án A
Khi đốt cháy hoàn toàn a mol X cũng như a mol Y đều thu được số mol CO2 nhiều hơn số mol H2O là a mol chứng tỏ cả X, Y đều có
chứng tỏ có anđehit 2 chức.
Sau phản ứng chỉ thu được một muối amoni của axit hữu cơ
Vậy
|
Khi đốt cháy a mol chất hữu cơ thu được số mol CO2 nhiều hơn số mol H2O là a mol:
Vậy số liên kết trong chất hữu cơ là 2. |
Câu 35:
Hòa tan hết m gam hỗn hợp gồm Ba, BaO, Al và Al2O3 trong nước dư, thu được a mol H2 và dung dịch X. Cho từ từ dung dịch H2SO4 1M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
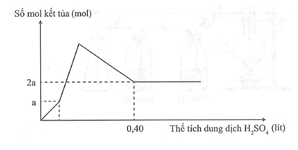
Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Phân tích đồ thị:
- Giai đoạn 1: Ba(OH)2 tác dụng với H2SO4
Lúc này chỉ có kết tủa BaSO4
- Giai đoạn 2: Ba(AlO2)2 tác dụng với H2SO4, lúc này, kết tủa BaSO4 và Al(OH)3 đều max.
- Giai đoạn 3: Al(OH)3 tác dụng với H2SO4, lúc này kết tủa Al(OH)3 tan hết, chỉ còn kết tủa BaSO4 nên sau giai đoạn này, đồ thị đi ngang.
Vậy
BTNT Al, Ba
BT e:
|
Việc phân tích đúng phản ứng các chất qua đồ thị rất quan trọng trong giải các bài tập đồ thị: Ở bài trên, nhận thấy đồ thị có 4 giai đoạn cụ thể: - Giai đoạn 1: Ba(OH)2 tác dụng H2SO4, lúc này chỉ có kết tủa BaSO4. - Giai đoạn 2: Ba(AlO2)2 tác dụng H2SO4, lúc này, kết tủa BaSO4 và Al(OH)3 đều max. - Giai đoạn 3: Al(OH)3 tác dụng H2SO4, lúc này kết tủa Al(OH)3 tan hết, chỉ còn kết tủa BaSO4. - Giai đoạn 4: BaSO4 không tan nên nên đồ thị đi ngang. Vậy số liên kết trong chất hữu cơ là 2. |
Câu 36:
Cho vào hai ống nghiệm mỗi ống 2 ml etyl axetat, sau đó thêm vào ống thứ nhất 1 ml dung dịch H2SO4 20%, vào ống thứ hai 1 ml dung dịch NaOH 30%. Chất lỏng trong cả hai ống nghiệm đều tách thành hai lớp. Sau đó, lắc đều cả hai ống nghiệm, lắp ống sinh hàn đồng thời đun cách thủy trong khoảng 5 – 7 phút. Hiện tượng trong hai ống nghiệm sau khi đun là
 Xem đáp án
Xem đáp án
Đáp án D
Thí nghiệm 1: este thủy phân trong môi trường axit là phản ứng thuận nghịch nên sau khi phản ứng xảy ra vẫn còn este nên hỗn hợp chất lỏng phân lớp.
Thí nghiệm 2: este thủy phân trong môi trường bazơ là phản ứng một chiều, sau phản ứng chỉ có muối và ancol nên hỗn hợp chất lỏng đồng nhất.
Câu 37:
Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO trong đó oxi chiếm 25,39% khối lượng hỗn hợp. Cho m gam hỗn hợp X tác dụng với 8,96 lít CO (đktc) sau một thời gian thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với Hiđro là 19. Cho chất rắn Y tác dụng với dung dịch HNO3 loãng, dư thu được dung dịch T và 7,168 lít NO (đktc, sản phẩm khử duy nhất). Cô cạn dung dịch T thu được 3,456m gam muối khan. Giá trị của m gần với giá trị nào sau đây nhất?
 Xem đáp án
Xem đáp án
Đáp án C
Sau phản ứng với CO, số mol O mất đi bằng số mol CO2 bằng 0,25 mol
|
Đối với bài toán nhiệt luyện, có thể xem như chất khử CO, H2, Al lấy oxi từ oxit. Khối lượng chất rắn sau khi nhiệt luyện giảm chính là khối lượng oxi đã mất đi. |
Câu 38:
Hỗn hợp X gồm 2 chất hữu cơ thành phần chỉ chứa (C, H, O), no, đơn chức, mạch hở. Cho m gam hỗn hợp X tác dụng vừa đủ với 100 ml dung dịch KOH 4M thu được 1 muối và 0,15 mol 1 ancol. Đem đốt cháy hoàn toàn m gam hỗn hợp X rồi cho sản phẩm cháy hấp thụ hết vào bình đựng dung dịch nước vôi trong dư thì khối lượng bình tăng thêm 68,2 gam. Công thức cấu tạo 2 chất hữu cơ trong X là
 Xem đáp án
Xem đáp án
Đáp án A
X tác dụng với KOH nên X chứa axit hoặc este hoặc cả 2.
, chứng tỏ trong X chứa axit đơn chức và este đơn chức.
Câu 39:
Cho thí nghiệm mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl:
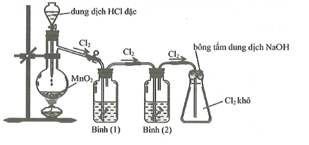
Cho các phát biểu sau:
(a) Bình 1 để hấp thụ khí HCl, bình 2 để hấp thụ hơi nước.
(b) Có thể đổi vị trí của bình 1 và bình 2 cho nhau.
(c) Sử dụng bông tẩm kiềm để ngăn khí Cl2 thoát ra ngoài môi trường.
(d) Chất lỏng sử dụng trong bình 1 lúc đầu là nước cất.
(e) Có thể thay thế HCl đặc bằng H2SO4 đặc, khi đó chất rắn trong bình cầu là HCl và KMnO4.
(f) Bình 2 đựng H2SO4 đặc có thể thay thế bằng bình đựng CaO (viên).
Số phát biểu không đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Những phát biểu sai: (b), (d), (e)
(a) đúng. Bình 1 chứa NaCl bão hòa, dùng để giữ khí HCl vì khí này tan trong NaCl bão hòa. Bình 2 chứa H2SO4 đặc để hấp thụ nước vì H2SO4 đặc có tính háo nước hay nước tan tốt trong H2SO4 đặc.
(b) sai. Nếu đổi vị trí thì khí thu được không còn là khí Cl2 khô, có thể lẫn hơi nước.
(c) đúng. Dung dịch NaOH tác dụng được với khí Cl2.
(d) sai. Chất lỏng đó là NaCl bão hòa.
(e) sai. Không dùng HCl đặc để hấp thụ nước.
(f) đúng. CaO viên là chất rắn hấp thụ nước tốt.
Câu 40:
Cho X, Y, Z là ba peptit đều mạch hở và Đốt cháy hoàn toàn a mol mỗi peptit X, Y hoặc Z đều thu được số mol CO2 nhiều hơn số mol H2O là a mol. Mặt khác, nếu đun nóng 69.8 gam hỗn hợp E (chứa X, Y và 0,16 mol Z; số mol của X nhỏ hơn số mol của Y) với dung dịch NaOH vừa đủ, thu được dung dịch chỉ chứa 2 muối của alanin và valin có tổng khối lượng 101,04 gam. Phần trăm khối lượng của X có trong hỗn hợp E gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
X, Y, Z có dạng:
Vậy X, Y, Z đều là tetrapeptit.
Vì nên trong Z chỉ chứa Ala. Vậy Z:
2 peptit còn lại:
TH1:
(loại)
TH2: (chọn)
