(2024) Đề minh họa tham khảo BGD môn Hóa có đáp án (9)
-
99 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 9:
Ở nhiệt độ cao, kim loại Fe tác dụng với khí Cl2 thu được muối trong đó sắt có số oxi hóa là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 11:
Trong các chất dưới đây, chất góp phần nhiều nhất vào sự hình thành mưa axit là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 12:
Ngâm một lá Fe vào dung dịch HCl sẽ có hiện tượng sủi bọt khí H2 thoát ra trên bề mặt lá sắt. Bọt khí sẽ sinh ra nhiều hơn khi thêm vào vài giọt dung dịch chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 14:
Độ dinh dưỡng của phân đạm được đánh giá theo tỉ lệ phần trăm về khối lượng của nguyên tố nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 17:
Natri cacbonat là một hóa chất phổ biến được sử dụng để làm mềm nước cứng. Công thức của natri cacbonat là.
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 18:
Trong công nghiệp, kim loại Ag được điều chế chủ yếu bằng phương pháp nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 19:
Nhỏ vài giọt nước brom vào ống nghiệm chứa anilin, hiện tượng quan sát được là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 20:
Axit panmitic là một axit béo có trong mỡ động vật và dầu cọ. Số nguyên tử cacbon trong phân tử axit panmitic là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 22:
Trong công nghiệp, saccarozơ là nguyên liệu để thủy phân thành glucozơ và fructozơ dùng trong kĩ thuật tráng gương, ruột phích. Để thu được 1,8 tấn glucozơ cần thủy phân m tấn saccarozơ với hiệu suất phản ứng là 60%. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 23:
Thuỷ phân hoàn toàn a gam một triglixerit X thu được 0,92 gam glixerol, 3,04 gam natri oleat và m gam muối natri stearat. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 24:
Polisaccarit X là chất rắn, màu trắng, dạng sợi. Trong bông nõn có gần 98% chất X. Thủy phân X, thu được monosaccarit Y. Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 25:
Cho bốn dung dịch sau: H2SO4, AlCl3, Ca(HCO3)2, Fe(NO3)3. Số dung dịch tác dụng hết với lượng dư dung dịch NaOH thu được kết tủa là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 26:
Dẫn luồng khí CO dư đi qua ống sứ đựng 11,52 gam Fe2O3 đun nóng, sau phản ứng hòa toàn toàn thì thu được nhiêu gam Fe?
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 27:
Cho 13,50 gam một amin đơn chức X tác dụng hết với dung dịch HCl, thu được 24,45 gam muối. Số công thức cấu tạo của X thỏa mãn tính chất trên là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 28:
Tơ nilon-6,6 dùng để dệt vải may mặc, vải lót săm lốp xe, dệt bít tất, bện làm dây cáp, dây dù, đan lưới,… Công thức cấu tạo của tơ nilon-6,6 được biểu diễn ở hình dưới đây:
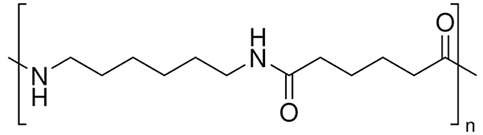
Phát biểu nào sau đây là không đúng khi nói về tơ nilon-6,6?
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 29:
Cho 0,69 gam kim loại kiềm X tác dụng nước dư, sau phản ứng thu được 0,336 lít H2 (đktc). Kim loại X là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 30:
Este X có công thức phân tử C4H8O2. Thủy phân X trong dung dịch NaOH dư, thu được sản phẩm gồm muối Y và ancol Z (bậc II). Công thức của X là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 31:
Chất hữu cơ E có công thức là C4H9O4N. Cho E tác dụng với dung dịch NaOH thu được ancol F, chất X là muối của amino axit Y và chất Z là muối của axit cacboxylic T.
Cho các phát biểu sau:
(a) Có 2 đồng phân cấu tạo của E thỏa mãn.
(b) Ở điều kiện thường, chất F tan vô hạn trong nước.
(c) 1 mol chất X tác dụng tối đa với 2 mol HCl trong dung dịch.
(d) Dung dịch chất T tham gia phản ứng tráng bạc.
(e) Dung dịch chất Y làm quỳ tím chuyển sang màu hồng.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Theo đề chất E thỏa mãn là HCOO-NH3-CH2-COO-CH3
F là CH3OH, X là H2NCH2COONa, Y là H2NCH2COOH, Z là HCOONa và T là HCOOH.
(a) Sai, có 1 đồng phân của E thỏa mãn.
(b) Đúng, CH3OH tan vô hạn trong nước.
(c) Đúng. H2NCH2COONa + 2HCl ® ClH3NCH2COOH + NaCl
(d) Đúng.
(đ) Sai, dung dịch glyxin không làm đổi màu quỳ tím.
Câu 32:
Theo TCVN 5502: 2003, dựa vào độ cứng của nước (được xác định bằng tổng hàm lượng Ca2+ và Mg2+ quy đổi về khối lượng CaCO3, có trong 1 lít nước), người ta có thể phân nước thành 4 loại:
|
Phân loại nước |
Mềm |
Hơi cứng |
Cứng |
Rất cứng |
|
Độ cứng (mg CaCO3/lít) |
0 – 50 |
51 – 150 |
151 – 300 |
≥ 301 |
Một mẫu nước (Y) có chứa các ion Mg2+; Ca2+; (2.10–3 mol/lít), (3.10–4 mol/lít) và (1.10–4 mol/lít). Hãy cho biết mẫu nước (Y) trên thuộc loại nước nào?
 Xem đáp án
Xem đáp án
Bảo toàn điện tích (mỗi Mg2+ được thay bằng 1Ca2+):
CM (Ca2+) = (2.10–3.2 + 3.10–4 + 1.10–4)/2 = 2,2.10-3 mol/lít
Độ cứng = \(\frac{{{m_{CaC{O_3}}}}}{{l\'i t}} = \frac{{2,{{2.10}^{ - 3}}.100.1000}}{{l\'i t}} = \) 220 mg/lít
Mẫu nước (Y) trên thuộc loại nước cứng (150-300).
Câu 33:
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Lấy vào ống nghiệm thứ nhất 0,5 ml dung dịch HNO3 68% và ống nghiệm thứ hai 0,5 ml dung dịch HNO3 15%.
Bước 2: Cho vào mỗi ống nghiệm một mảnh nhỏ đồng kim loại. Nút các ống nghiệm bằng bông tẩm dung dịch NaOH. Đun nhẹ ống nghiệm thứ hai.
Cho các phát biểu sau:
(a) Ở hai ống nghiệm, mảnh đồng tan, dung dịch chuyển dần sang màu xanh.
(b) Trong bước 2, ở ống nghiệm thứ nhất có khí màu nâu đỏ thoát ra.
(c) Bông tẩm dung dịch NaOH có tác dụng hạn chế khí độc thoát ra khỏi ống nghiệm.
(d) Trong bước 2, Cu bị oxi hóa thành ion Cu2+ ở cả hai ống nghiệm.
(e) Có thể thay bông tẩm dung dịch NaOH bằng bông tẩm dung dịch NaCl.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Ống 1: Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
Ống 2: Cu + HNO3 Cu(NO3)2 + NO + H2O
2NO + O2 2NO2
(a) Đúng, muối Cu2+ có màu xanh.
(b) Đúng, NO2 có màu nâu đỏ.
(c) Đúng, NaOH hấp thụ khí NO2 độc.
(d) Đúng, Cu khử (bị oxi hóa) HNO3 thành Cu2+.
(đ) Sai, NaCl không hấp thụ được NO2.
Câu 34:
Cho m gam hỗn hợp X gồm FeS2, FeCO3, CuO và Fe2O3 (trong X nguyên tố oxi chiếm 15,2% về khối lượng) vào bình kín (thể tích không đổi) chứa 1,08 mol O2 (dư). Nung nóng bình đến khi các phản ứng xảy ra hoàn toàn rồi đưa về nhiệt độ ban đầu thì áp suất trong bình giảm 10% so với áp suất ban đầu (coi thể tích chất rắn thay đổi không đáng kể). Mặt khác, hòa tan hết m gam X bằng dung dịch H2SO4 đặc nóng, thu được dung dịch Y chứa 1,8m gam hỗn hợp muối (gồm Fe2(SO4)3, CuSO4) và 2,16 mol hỗn hợp khí gồm CO2, SO2. Giá trị của m là
 Xem đáp án
Xem đáp án
Đặt a, b lần lượt là số mol FeS2, FeCO3
Chất khí sau phản ứng nung gồm SO2 (2a mol), CO2 (b mol) và O2 dư
Áp suất giảm 10% Þ số mol khí giảm là 1,08.10% = 0,108 mol
Bảo toàn e: 4\[{n_{{O_2}}}\]phản ứng = 11a + b Þ \[{n_{{O_2}}}\]phản ứng = 2,75a + 0,25b
Số mol khí sau pư: 2a + b + (1,08 – 2,75a – 0,25b) = 1,08 – 0,108 Þ 0,75a – 0,75b = 0,108 (1)
Khi cho X tác dụng với H2SO4 đặc nóng, bảo toàn electron: \({n_{S{O_2}}} = \frac{{{\rm{ }}(15a + b)}}{2}\)
Theo mol hỗn hợp CO2, SO2 ta có: \(\frac{{{\rm{ }}(15a + b)}}{2}\) + b = 2,16 (2)
Từ (1), (2) Þ a = 0,264; b = 0,12
Đặt x, y là số mol CuO và Fe2O3 Þ m = 80x + 160y + 0,264.120 + 0,12.116
Theo mol: nO = x + 3y + 3.0,12 = \[\frac{{0,152m}}{{16}}\]
mmuối = 160x + \[400.\frac{{\left( {2y + 0,264 + 0,12} \right)}}{2}\] = 1,8m
Kết luận: x = 0,12; y = 0,03; m = 60gCâu 35:
Hỗn hợp E gồm ba este mạch hở X, Y (đều đơn chức; MX < MY) và Z (trong phân tử có số liên kết pi nhỏ hơn 4). Đốt cháy hoàn toàn m gam E, thu được 1,65 mol CO2. Cho m gam E tác dụng vừa đủ với dung dịch NaOH, thu được hỗn hợp T gồm hai ancol no (có cùng số nguyên tử cacbon) và 39 gam hỗn hợp muối của hai axit cacboxylic kế tiếp trong dãy đồng đẳng. Cho toàn bộ T tác dụng với Na dư, thu được 0,225 mol H2. Khối lượng của Y trong m gam E là
 Xem đáp án
Xem đáp án
Cho hỗn hợp ancol T tác dụng với Na Þ nOH = 2\[{n_{{H_2}}}\] = 0,45 mol
Từ phản ứng thủy phân Þ nCOO = nNaOH = nOH = nCOONa = 0,45 mol
mà X, Y là 2 este đơn chức nên hai muối thu được đều là muối đơn với số mol là 0,45
MRCOONa = 86,6 ® CH3COONa và C2H5COONa (kế tiếp nhau)
Giải hệ pt 2 ần gồm pt 39g và 0,45 mol muối tìm được CH3COONa: 0,3 mol và C2H5COONa: 0,15 mol
Vì 2 ancol thu được có cùng số C và este Z (có số p < 4: tối đa 3 chức) nên ta xét 1 số trường hợp xảy ra đối với ancol như sau:
Trường hợp 1: C2H5OH và C2H4(OH)2
Bảo toàn C: nC(este) = nC(muối) + nC(ancol) Þ nC(ancol) = 1,65 – 0,3.2 – 0,15.3 = 0,6 mol
Đặt a, b là mol hai ancol Þ \(\left\{ \begin{array}{l}a + 2b = {n_{OH}} = 0,45\\2a + 2b = 0,6\end{array} \right. \Rightarrow a = b = 0,15\)
Ba este CH3COOC2H5 (x), C2H5COOC2H5 (y), R1-COO-CH2-CH2-OOC-R2 (0,15 mol)
Nhận thấy y = 0,15 ® x = 0 (vô lý)
Trường hợp 2: C3H7OH và C3H6(OH)2
Làm tương tự ra nghiệm âm
Trường hợp 3: C3H7OH và C3H5(OH)3
Làm tương tự ra a = 0,075 ; b = 0,125
Ba este CH3COOC3H7 (x), C2H5COOC3H7 (y), Z (3 chức: 0,125 mol)
Lại x + y = 0,075 và y + 0,125 = 0,15 Þ y = 0,025 ; x = 0,05
Vậy mY = 2,9g.
Câu 36:
Cho các phát biểu sau:
(a) Có thể dùng nước rửa trôi vết bám dầu mỡ trên quần áo.
(b) Axit glutamic là chất rắn dạng tinh thể, màu trắng, dễ tan trong nước.
(c) Tơ nitron kém bền trong môi trường axit và môi trường kiềm.
(d) Nhỏ dung dịch I2 vào mặt cắt củ khoai lang thấy xuất hiện màu xanh tím.
(e) Xăng sinh học E5 là hỗn hợp của xăng truyền thống với 5% cồn sinh học (metanol).
Số phát biểu sai là
 Xem đáp án
Xem đáp án
(a) Sai, dầu mỡ không tan trong nước nên không thể bị rửa trôi dễ dàng bởi nước.
(b) Sai, axit glutamic không màu.
(c) Sai, tơ nitron bền môi trường axit và môi trường kiềm.
(d) Đúng, thành phần của củ khoai có chứa tinh bột nên có phản ứng màu với iot.
(đ) Sai, cồn sinh học etanol 5%.
Câu 37:
Thực hiện phản ứng tổng hợp amoniac từ N2 và H2 với hiệu suất phản ứng là H%, thu được hỗn hợp X có tỉ khối so với H2 là 5,75. Dẫn X qua môi trường lạnh để NH3 hóa lỏng hoàn toàn, thu được hỗn hợp khí Y (gồm hai khí) có tỉ khối so với H2 là 5,0625. Giá trị của H là
 Xem đáp án
Xem đáp án
\[\begin{array}{l}\;\;\;\;\;N{}_2\;\;\;\;\; + \;\;\;\;\;3{H_2}\;\;\;\;\; \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \;\;\;\;\;2N{H_3}\\\;\;\;\;\;\;a\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;b\\\;\;\;\;\;\;x\;\;\;\;\;\;\;\;\;\;\;\;\;\;3x\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;2x\\\;\;\;\;a - x\;\;\;\;\;\;\;\;\;b - 3x\;\;\;\;\;\;\;\;\;\;\;\;\;\;2x\end{array}\]
nX = (a – x) + (b – 3x) + 2x = a + b – 2x
Sau khi hóa lỏng NH3 thì Y gồm N2 dư và H2 dư
Lập sơ đồ đường chéo Þ \(\frac{{a - x}}{{b - 3x}} = \frac{5}{{11}} \Rightarrow 11a = 5b - 4x\) (1)
BTKL: mN2 + mH2 = mX Þ 28a + 2b = 5,75.2.(a + b – 2x) Þ 16,5a = 9,5b – 23x (2)
Cho x = 1, giải hệ tìm a = 3,5 và b = 8,5
So sánh \(\frac{a}{1}\) với \(\frac{b}{3}\) ta tính hiệu suất phản ứng theo H2 (lượng nhỏ hơn) Þ H = \(\frac{3}{{8,5}}.100 = 35,3\% \)
Câu 38:
Nung hỗn hợp bột gồm Al và Fe3O4 (theo tỉ lệ mol tương ứng 14 : 3) trong điều kiện không có oxi, thu được hỗn hợp rắn X. Cho X vào dung dịch Ba(OH)2 dư, thu được dung dịch Y, chất rắn không tan Z và khí T. Biết các phản ứng xảy ra hoàn toàn. Cho các phát biểu sau:
(a) Sục khí CO2 dư vào Y, thu được hỗn hợp kết tủa.
(b) Dẫn khí T qua bình đựng CuO, nung nóng thu được kim loại Cu.
(c) Hỗn hợp rắn X tan hết trong dung dịch HCl loãng dư.
(d) Số mol chất rắn Z bằng số mol khí T sinh ra.
(đ) Trong tự nhiên, Z có trong các thiên thạch (là khối chất rắn từ ngoài Trái Đất rơi xuống).
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
8Al + 3Fe3O4 4Al2O3 + 9Fe
Bđ 14 3
Pư 8 3 4 9
Dư 6 0
Hỗn hợp rắn X gồm Al dư, Al2O3, Fe
Dung dịch Y gồm Ba(OH)2, Ba(AlO2)2; rắn Z là Fe và khí T là H2.
Theo BTe: 3nAl dư = 2\[{n_{{H_2}}}\] ® \[{n_{{H_2}}}\] = 9 mol
(a) Sai, CO2 dư nên chỉ thu được 1 kết tủa duy nhất là Al(OH)3.
(b) Đúng, H2 khử CuO ở nhiệt độ cao thu được Cu.
(c) Đúng, các chất trong X đều phản ứng với dung dịch HCl dư và tan hết.
(d) Đúng, nFe = \[{n_{{H_2}}}\] = 9 mol
(đ) Đúng, trong tự nhiên, sắt ở trạng thái tự do trong các mảnh thiên thạch.
Câu 39:
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 2,755 gam X vào nước, thu được 0,224 lít khí H2 (đktc) và 500 ml dung dịch Y có pH = 13. Sục V lít khí CO2 (đktc) vào Y, thu được m gam kết tủa. Thêm tiếp V lít khí CO2 (đktc) nữa vào thì lượng kết tủa thu được là 0,5m gam. Giá trị của V là
 Xem đáp án
Xem đáp án
Quy đổi X thành Na (x), Ba (y) và O (z) Þ mX = 23x + 137y + 16z = 2,755 (1)
Bảo toàn e: x + 2y = 2z + 0,01.2 (2)
Xét dung dịch Y chứa NaOH (x) và Ba(OH)2 (y) Þ \[{n_{O{H^ - }}}\] = x + 2y = 0,1.0,5
Từ (1), (2), (3) suy ra: x = 0,02; y = 0,015; z = 0,015
TN1: \[{n_{C{O_2}}}\] = a mol và \[{n_{BaC{O_3}}}\] = b mol
TN2: \[{n_{C{O_2}}}\] = 2a mol \[{n_{BaC{O_3}}}\]= 0,5b mol
Nhận xét: TN2 có CO2 tăng, kết tủa giảm nên kết tủa đã bị hòa tan.
Þ \[{n_{O{H^ - }}}\]\[ - {\rm{ }}{n_{C{O_2}}} = {\rm{ }}{n_{BaC{O_3}}}\] Þ 0,05 – 2a = 0,5b (1)
Nếu TN1 kết tủa chưa bị hòa tan (a ≤ x + y)
+ Chỉ Ba(OH)2 phản ứng: a = b và kết hợp (1) Þ a = b = 0,02 (loại vì a > y nên NaOH đã pư)
+ Cả NaOH đã phản ứng: b = y = 0,015 và kết hợp (1) a = 0,02125 Þ V = 0,476 lít
Nếu TN1 kết tủa đã bị hòa tan (a > x + y)
\[{n_{O{H^ - }}}\]\[ - {\rm{ }}{n_{C{O_2}}} = {\rm{ }}{n_{BaC{O_3}}}\] Þ 0,05 – a = b (2). Kết hợp (1) Þ b = 0,033 (vô lý vì mol kết tủa max là 0,015)
Câu 40:
Xăng sinh học E10 là nhiên liệu hỗn hợp giữa 10% etanol và 90% octan về khối lượng, còn có tên là gasohol. Hiện nay có khoảng 40 nước trên thế giới đang sử dụng nhiên liệu này trong các động cơ đốt trong của xe hơi và phương tiện giao thông tải trọng nhẹ. Biết rằng nhiệt lượng cháy của nhiên liệu đo ở điều kiện tiêu chuẩn (25°C, 100kPa) được đưa trong bảng dưới đây:
|
Nhiên liệu |
Trạng thái |
Nhiệt lượng cháy (kJ/g) |
|
Etanol |
Lỏng |
29,6 |
|
Octan |
Lỏng |
47,9 |
Để sản sinh năng lượng khoảng 2550 MJ (1 MJ = 106 J) thì cần đốt cháy hoàn toàn bao nhiêu kg xăng E10 ở điều kiện chuẩn (lấy giá trị gần đúng nhất)?
 Xem đáp án
Xem đáp án
Để sản sinh năng lượng khoảng 2550 MJ = 2,55.106 kJ thì cần đốt cháy hoàn toàn m gam xăng gồm 0,1m gam C2H5OH (Etanol) và 0,9m gam C8H18 (Octan)
Q = 29,6.0,1m + 47,9.0,9m = 2,55.106 Þ m = 55350 g = 55,35 kg
