(2024) Đề minh họa tham khảo BGD môn Hóa có đáp án (19)
-
83 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 2:
Cho các kim loại sau: Na, Cu, Al, Cr. Kim loại dẫn điện tốt nhất trong dãy là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 4:
Ở điều kiện thường, kim loại nào sau đây tác dụng với bột lưu huỳnh?
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 5:
Phản ứng nào sau đây là phản ứng điều chế kim loại theo phương pháp nhiệt luyện?
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 6:
Chất nào sau đây tác dụng được với dung dịch HNO3 loãng không sinh ra sản phẩm khử?
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 7:
Kim loại dùng để sản xuất dây dẫn truyền tải điện năng ngoài trời (cao thế, trung thế...) là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 12:
Trong công nghiệp sản xuất đường, chất khí X được dùng để tẩy màu cho dung dịch nước đường trong dây truyền sản xuất saccarozơ. Khí X là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 15:
Khi bị ốm, mất sức, nhiều người bệnh thường được truyền dịch đường để bổ sung nhanh năng lượng. Chất trong dịch truyền có tác dụng trên là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 17:
Dung dịch chứa Ala-Gly-Ala không phản ứng được với dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 19:
Các loại phân lân cung cấp cho cây trồng nguyên tố dinh dưỡng nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 21:
Để thu được Ag tinh khiết từ quặng bạc có lẫn Cu, người ta cho quặng bạc đó vào dung dịch chứa chất X dư. Chất X là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 22:
Cho các loại tơ sau: nilon-6, nitron, visco, axetat, bông, tơ tằm, nilon - 6,6. Số lượng tơ thiên nhiên, tổng hợp và nhân tạo lần lượt là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 23:
Cho 5,4 gam Al tác dụng với 100 ml dung dịch NaOH 1M đến khi phản ứng xảy ra hoàn toàn, thu được V lít khí H2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 24:
Dung dịch Fe(NO3)2 tác dụng với dung dịch X không tạo ra hợp chất Fe(III). X có thể là chất nào dưới đây?
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 25:
Hòa tan hoàn toàn 14,40 gam kim loại M (hóa trị II) trong dung dịch H2SO4 loãng (dư) thu được 13,44 lít khí H2 (đktc). Kim loại M là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 26:
Este X mạch hở có công thức phân tử là C4H6O2. Khi đun X với dung dịch KOH, thu được muối Y và chất hữu cơ Z, biết MX < MY. Số công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 27:
Cho sơ đồ chuyển hóa sau (mỗi mũi tên là một phương trình phản ứng):
Tinh bột → X → Y → Z → metyl axetat.
Các chất Y, Z trong sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 28:
Khối lượng saccarozơ thu được từ một tấn mía chứa 13% saccarozơ, với hiệu suất phản ứng đạt 80% là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 29:
Đốt cháy hoàn toàn amin X no, đơn chức, mạch hở, thu được 8,96 lít CO2 (đktc) và 0,1 mol N2. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 31:
Hỗn hợp E gồm chất X (C2H10N2O3, muối của axit vô cơ), chất Y (C3H10O2N2, muối của α-amino axit). Cho E tác dụng hoàn toàn với dung dịch NaOH (đun nóng), thu được hỗn hợp khí G. Cho E tác dụng hoàn toàn với dung dịch H2SO4 (loãng, dư, đun nóng), thu được khí T và dung dịch Q. Cho các nhận định sau:
(a) Chất Y có 2 công thức cấu tạo thỏa mãn.
(b) Chất T là một trong các khí gây hiệu ứng nhà kính.
(c) Hỗn hợp G chứa 2 khí đều làm quỳ tím hoá xanh và tan tốt trong nước.
(d) Cho khí T phản ứng với khí có phân tử khối nhỏ hơn trong G (to cao và P cao, có mặt xúc tác) sẽ tạo thành một loại phân bón hoá học.
(e) Chất X là muối của axit nitric.
Số nhận định đúng là
 Xem đáp án
Xem đáp án
Cấu tạo của X: CH3NH3-CO3-NH4
Cấu tạo của Y:
H2N-CH2-COO-NH3-CH3
H2N-CH(CH3)-COO-NH4
G gồm NH3, CH3NH2; T là CO2
Q chứa: CH3NH3HSO4; NH4HSO4; HOOC-CH2-NH3HSO4; HOOC-CH(CH3)-NH3HSO4, H2SO4 dư.
(a) Đúng, Y có 2 công thức cấu tạo thỏa mãn.
(b) Đúng.
(c) Đúng.
(d) Đúng, vì 2NH3 + CO2 → (NH2)2CO (ure) + H2O
(e) Sai
Câu 32:
Hòa tan hết m gam hỗn hợp gồm Na, Na2O, Ba và BaO vào nước dư, thu được dung dịch X và 0,3 mol khí H2. Sục 0,64 mol khí CO2 vào X, thu được dung dịch Y chỉ chứa các muối và kết tủa Z. Chia dung dịch Y làm 2 phần bằng nhau:
+ Cho từ từ phần 1 vào 400 ml dung dịch HCl 0,6M thu được 0,15 mol khí CO2.
+ Cho từ từ 400 ml dung dịch HCl 0,6M vào phần 2, thu được 0,12 mol khí CO2.
Biết các phản ứng xảy ra hoàn toàn. Phần trăm về khối lượng của O trong m gam hỗn hợp ban đầu là:
 Xem đáp án
Xem đáp án
Xét phần 1: \[\left\{ \begin{array}{l}{n_{HC{O_3}^ - }} + {n_{C{O_3}^{2 - }}} = {n_{C{O_2}}} = 0,15\\{n_{HC{O_3}^ - }} + 2{n_{C{O_3}^{2 - }}} = {n_{{H^ + }}} = 0,24\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{n_{HC{O_3}^ - }} = 0,06\;mol\\{n_{C{O_3}^{2 - }}} = 0,09\;mol\end{array} \right. \to \frac{{{n_{HC{O_3}^ - }}}}{{{n_{C{O_3}^{2 - }}}}} = \frac{2}{3}\] (tỉ lệ mol phản ứng)
Xét phần 2: \[{n_{C{O_3}^{2 - }}} = {n_{{H^ + }}} - {n_{C{O_2}}} = 0,12\,mol \Rightarrow {n_{HC{O_3}^ - }} = 0,08\;mol\]
=> %mO = 8,04%
Câu 33:
Cho các phát biểu sau:
(a) Nước ép của quả nho chín có phản ứng màu biure.
(b) Vải làm từ nilon-6,6 kém bền trong nước xà phòng có tính kiềm cao.
(c) Nhỏ dung dịch iot vào mặt cắt quả chuối xanh, xuất hiện màu xanh tím.
(d) Có thể sử dụng bia để loại bỏ mùi tanh của hải sản khi hải sản được hấp với bia.
(e) Khi ăn cam và uống sữa cùng nhau dễ gây hiện tượng chướng, đau bụng, tiêu chảy.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, nước ép nho chín chứa chủ yếu nước và một số loại đường, hầu như không có protein hòa tan nên không có phản ứng màu biurê.
(b) Đúng, Nilon – 6,6 bị thuỷ phân trong môi trường kiềm.
(c) Đúng, chuối xanh chứa nhiều tinh bột, tạo màu xanh tím với I2.
(d) Đúng, trong bia có khoảng 5% nồng độ cồn. Trong quá trình cồn bốc hơi thì cũng mang theo mùi tanh của cá bốc hơi theo.
(e) Đúng, sữa chứa protein hòa tan sẽ bị đông tụ, có thể tạo thành chất độc khi ăn chung với cam (chứa vitamin và axit)
Câu 34:
Đun nóng m gam hỗn hợp E chứa triglixerit X và các axit béo tự do với 400 ml dung dịch NaOH 1M (vừa đủ), thu được hỗn hợp Y chứa các muối có công thức chung C17HyCOONa. Đốt cháy 0,14 mol E thu được 3,69 mol CO2. Mặt khác m gam E tác dụng vừa đủ với 0,2 mol Br2. Các phản ứng xảy ra hoàn toàn. Giá trị của y và m là
 Xem đáp án
Xem đáp án
Cách 1
Quy đổi m gam hỗn hợp E thành:
\[\left\{ {\begin{array}{*{20}{c}}{{C_{17}}{H_y}COOH:a}\\\begin{array}{l}{C_3}{H_5}{(OH)_3}:b\\{H_2}O: - 3b\end{array}\end{array}} \right.\] (mol)
m gam E + NaOH => a = nNaOH = 0,4 mol
m gam E + 0,2 mol Br2, chỉ có C17HyCOOH phản ứng:
\({C_{17}}{H_y}COOH = > {C_{18}}{H_{y + 1}}{O_2}\)
Giả sử C17HyCOOH có n liên kết π
C18Hy+1O2 + (n – 1) Br2
0,4 0,4(n – 1) = 0,2 => n = 1,5 => \(\frac{{2.18 + 2 - (y + 1)}}{2} = 1,5\) => y = 34
Trong 0,14 mol E \[\left\{ {\begin{array}{*{20}{c}}{{C_{17}}{H_y}COOH:ka}\\\begin{array}{l}{C_3}{H_5}{(OH)_3}:kb\\{H_2}O: - 3kb\end{array}\end{array}} \right.\]
Ta có: ka + kb – 3kb = 0,14 => ka – 2kb = 0,14 (1)
Số mol CO2 = 18ka + 3kb = 3,69 (2)
Từ (1) và (2) => ka = 0,2; kb = 0,03. Với a = 0,4 => k = 0,5; b = 0,06
=> m = 115,48 (g)
Cách 2:
Bảo toàn mol pi, Số mol pi trung bình: C = C = 0,2 : 0,4 = 0,5 => y = 34
TN1: Quy đổi \[\left\{ {\begin{array}{*{20}{c}}{{C_{17}}{H_{34}}COOH:0,4}\\{{C_3}{H_2}}\end{array}} \right.\]
TN2: 0,14 mol \[\left\{ {\begin{array}{*{20}{c}}{{C_{17}}{H_{34}}COOH:0,14 + 2x}\\{{C_3}{H_2}:x}\end{array}} \right. \to 3,69\]mol CO2
=> 18(0,14 + 2x) + 3x = 3,69 => x = 0,03 => C17H34COOH : 0,2 mol (Số mol TN2 = ½ số mol TN1)
=> m = (283.0,2 + 38.0,03).2 = 115,48 gam
Câu 35:
Thực hiện 5 thí nghiệm sau:
(a) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
(b) Cho K vào dung dịch CuSO4 dư.
(c) Cho dung dịch NH4NO3 vào dung dịch Ba(OH)2.
(d) Cho dung dịch NH3 đến dư vào dung dịch AlCl3.
(e) Cho dung dịch CO2 tới dư vào dung dịch gồm NaOH và Ca(OH)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
(a) Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓.
(b) \(K + {H_2}O \to KOH + {H_2}\)
\(KOH + CuS{O_4} \to {K_2}S{O_4} + Cu{(OH)_2}\)
(c) \(N{H_4}N{O_3} + Ba{(OH)_2} \to Ba{(N{O_3})_2} + N{H_3} + {H_2}O\)
(d) 3NH3 + AlCl3 + 3H2O → 3NH4Cl + Al(OH)3↓.
(e) CO2 dư + Ca(OH)2 \( \to Ca{\left( {HC{O_3}} \right)_2}\)
CO2 dư + NaOH \( \to NaHC{O_3}\)
Câu 36:
Tiến hành thí nghiệm theo các bước sau:
- Bước 1: Rót vào 2 ống nghiệm, mỗi ống khoảng 3 ml dung dịch AlCl3 rồi nhỏ từ từ dung dịch NH3 dư vào mỗi ống nghiệm.
- Bước 2: Nhỏ dung dịch H2SO4 loãng vào một ống, lắc nhẹ.
- Bước 3: Nhỏ dung dịch NaOH vào ống còn lại, lắc nhẹ.
Cho các nhận định sau:
(a) Ở bước 1, thu được kết tủa Al(OH)3.
(b) Ở bước 2, xảy ra hiện tượng kết tủa bị hòa tan.
(c) Ở bước 3, cũng xảy ra hiện tượng kết tủa bị hòa tan.
(d) Đây là thí nghiệm chứng minh tính lưỡng tính của nhôm hiđroxit.
(e) Ở bước 1, thay dung dịch AlCl3 bằng dung dịch NaAlO2 thì cũng thu được kết quả tương tự.
Số nhận định đúng là
 Xem đáp án
Xem đáp án
(a) Đúng, 3NH3 + AlCl3 + 3H2O → 3NH4Cl + Al(OH)3↓.
(b) Đúng, 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O.
(c) Đúng, NaOH + Al(OH)3 → NaAlO2 + 2H2O .
(d) Đúng.
(e) Sai.
Câu 37:
Cồn công nghiệp chứa hàm lượng metanol cao, khi uống phải vượt quá mức chấp nhận của cơ thể rất độc, uống lượng nhỏ gây mù mắt, nhiều hơn có thể tử vong. Do đó tuyệt đối không được uống cồn công nghiệp hoặc dùng cồn công nghiệp thay rượu uống. Khi uống vào, metanol gây tổn thương não, dây thần kinh thị giác, hoại tử não, tổn thương nội tạng.
Một mẫu cồn X (thành phần chính là C2H5OH) có lẫn metanol (CH3OH). Đốt cháy 23,032 gam cồn X tỏa ra nhiệt lượng 685,716 kJ. Biết rằng:
– Đốt cháy hoàn toàn 1 mol metanol toả ra lượng nhiệt là 716 kJ và 1 mol etanol toả ra lượng nhiệt là 1370 kJ.
– Hàm lượng metanol trong rượu uống quy định là không được lớn hơn 100 mg trên 1 L rượu tính theo độ rượu ethanol 100 độ, khối lượng riêng của C2H5OH là 0,8 gam/ml.
Nhận xét nào sau đây đúng?
 Xem đáp án
Xem đáp án
X chứa C2H5OH (a) và CH3OH (b)
mX = 46a + 32b = 23,032
Bảo toàn năng lượng: 1370a + 716b = 685,716
⟶ a = 0,5; b = 0,001
⟶ %CH3OH = 32b/31 = 0,14% => %C2H5OH = 99,86% (C,D sai)
VC2H5OH = 46a/0,8 = 28,75 ml = 0,02875 lít
mCH3OH = 0,032 gam = 32 mg
0,02875 lít ethanol chứa 32 mg CH3OH
⟶ 1 L ethanol chứa 1113 mg CH3OH > 100 nên không đạt tiêu chuẩn để pha chế rượu uống (A sai)
nH2 = a/2 + b/2 = 0,2505 ⟶ VH2 = 5,6112 lít (B đúng)
Câu 38:
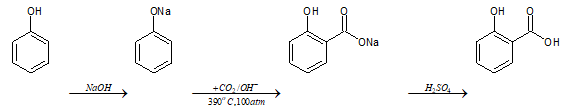
Axit Salixylic là thành phần của thuốc kháng viêm không chứa steroid, thường gặp trong các loại thuốc được dùng để điều trị bệnh về da. Acnes Sealing Jell với dạng gel trong suốt, thẩm thấu nhanh qua da, có tác dụng mạnh trong việc làm sạch mụn đầu đen, đầu trắng. Trong 1 tuýp Acnes 18g có chứa 2% axit Salixylic.
Axit Salixylic được tổng hợp từ phenol theo sơ đồ sau:

 Xem đáp án
Xem đáp án
\({m_{{\rm{Ax}}itSalixylic}} = 18.2\% = 0,36\)(gam)
C6H5OH C6H4(OH)(COOH)
94 138
Khối lượng axit Salixylic = \(\frac{{100.138.80}}{{94.100}} = 117,45\)(gam)
=> Số tuýp thuốc Acnes = 117,45 : 0,36 = 326 (tuýp)
Câu 39:
Điện phân (điện cực trơ, màng ngăn xốp) dung dịch gồm CuSO4 và NaCl với cường độ dòng điện 5A đến khi nước bắt đầu bị điện phân ở hai điện cực thì dừng lại (thời gian điện phân lúc này là 2316 giây), thu được dung dịch Y có khối lượng giảm 6,45 gam so với dung dịch ban đầu. Cho 9 gam Fe(NO3)2 vào Y, sau phản ứng thu được dung dịch Z và khí NO (sản phẩm khử duy nhất của N+5). Cô cạn Z thu được m gam muối khan. Biết các phản ứng xảy ra hoàn toàn, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí và sự bay hơi của nước.
Cho các phát biểu sau:
1) Dung dịch Y có chứa H2SO4 (0,03 mol) và Na2SO4 (0,03 mol).
2) Thể tích khí NO là 0,336 lít.
3) Giá trị của m là 15,21 gam.
4) Sau khi điện phân được 2316 giây thì có 0,05 mol Cu bám vào catot.
5) Khối lượng dung dịch Y giảm là khối lượng của Cu, Cl2, O2 và H2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Ta có: ne = 0,12 mol ® Tại anot có khí Cl2 (x mol) và O2 (y mol) và tại catot có Cu (0,06 mol).
mà mdd giảm = 71x + 32y + 0,06.64 = 6,45 và 2x + 4y = 0,12 Þ x = 0,03 ; y = 0,015.
Dung dịch Y có chứa H2SO4 (0,015.2 = 0,03 mol) ; Na2SO4 (0,03 mol).
Khi cho 0,05 mol Fe(NO3)2 vào Y thì: \({n_{NO}} = \frac{{{n_{{H^ + }}}}}{4} = 0,015\;mol\)
Dung dịch Z chứa Fen+ (0,05), Na+ (0,06), SO42- (0,06), NO3- (0,1 – 0,015 = 0,085) Þ m = 15,21 (g)
Câu 40:
Đốt cháy hỗn hợp gồm Mg và Fe (có tỉ lệ khối lượng tương ứng là 18 : 35) trong oxi một thời gian thu được hỗn hợp chất rắn X. Hòa tan hết X bằng 200 gam dung dịch HNO3 38,115% thu được dung dịch muối Y (chứa 82,2 gam muối) và 1,792 lít hỗn hợp khí Z (ở đktc) gồm NO và N2O có tỉ khối hơi so với H2 là 20,25. Cho dung dịch NaOH dư vào dung dịch Y, lấy kết tủa nung trong điều kiện có không khi đến khối lượng không đổi thu được 25,6 gam chất rắn khan. Nồng độ phần trăm của Mg(NO3)2 trong dung dịch Y gần nhất với giá trị nào sau đây ?
 Xem đáp án
Xem đáp án
Từ hỗn hợp khí Z ta tính được: \[{n_{{N_2}O}}\]= 0,06 mol và nNO = 0,02 mol
Đặt a, b, c là số mol Mg2+, Fe3+, Fe2+ trong Y và x là số mol O trong X.
Ta có: \[{n_{HN{O_3}}} = 10{n_{{N_2}O}} + 4{n_N}_O + 10{n_{N{H_4}N{O_3}}} + {\rm{ }}2{n_O} \Rightarrow {n_{N{H_4}N{O_3}}} = 0,053--0,2x{\rm{ }}mol\]
\[\left\{ \begin{array}{l}24a/56\left( {b{\rm{ }} + {\rm{ }}c} \right) = 18/35\\148a + 242b + 180c + 80\left( {0,053--0,2x} \right) = 82,2\\40a + 160\left( {b{\rm{ }} + {\rm{ }}c} \right)/2 = 25,6\\2a + 3b + 2c = 2x + 0,06.8 + 0,02.3 + 8\left( {0,053--0,2x} \right)\end{array} \right.{\rm{ }}\] Þ \(\left\{ \begin{array}{l}a{\rm{ }} = {\rm{ }}0,24{\rm{ }}\\b{\rm{ }} = {\rm{ }}0,14{\rm{ }}\\c{\rm{ }} = {\rm{ }}0,06{\rm{ }}\\x{\rm{ }} = {\rm{ }}0,14\end{array} \right.\)
Khối lượng dung dịch Y = mX + mdung dịch\(_{HN{O_3}}\) – mZ = 213,72 gam
Þ C%Mg(NO3)2 = 148a/213,72 = 16,62%.
