Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (30 đề)
Bộ đề thi thử THPT Quốc gia năm 2022 môn Hóa có lời giải (Đề 26)
-
2450 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
 Xem đáp án
Xem đáp án
Câu 2:
Khi cho este E có công thức phân tử C3H6O2 tác dụng với dung dịch NaOH thì thu được muối và etanol. Este E có tên gọi là
 Xem đáp án
Xem đáp án
Câu 3:
Hòa tan hết 1,92 gam kim loại R (hóa trị II) trong dung dịch H2SO4 loãng, thu được 1,792 lít khí H2 (đktc). Kim loại R là
 Xem đáp án
Xem đáp án
Câu 4:
Al(OH)3 không tan được trong dung dịch chứa chất nào sau đây?
 Xem đáp án
Xem đáp án
Câu 6:
Chất nào sau đây làm mất màu dung dịch KMnO4 ở điều kiện thường?
 Xem đáp án
Xem đáp án
Câu 8:
Chất nào sau đây được dùng để làm mềm nước có tính cứng vĩnh cửu?
 Xem đáp án
Xem đáp án
Câu 9:
Cho vào ống nghiệm 3 – 4 giọt dung dịch CuSO4 2% và 2 – 3 giọt dung dịch NaOH 10%. Tiếp tục nhỏ 2 – 3 giọt dung dịch chất X vào ống nghiệm, lắc nhẹ, thu được dung dịch màu xanh lam. Chất X không thể là
 Xem đáp án
Xem đáp án
Chọn D.
Chất X hòa tan tạo dung dịch màu xanh lam là axit hoặc ancol đa chức (ít nhất 2OH kề nhau)
X không thể là etanol
Câu 10:
Trộn bột kim loại X với bột oxit sắt (gọi là hỗn hợp tecmit) để thực hiện phản ứng nhiệt nhôm dùng để hàn đường ray tàu hỏa. Kim loại X là
 Xem đáp án
Xem đáp án
Câu 11:
Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xương?
 Xem đáp án
Xem đáp án
Câu 12:
Dùng Al dư khử hoàn toàn 6,4 gam Fe2O3 thành Fe bằng phản ứng nhiệt nhôm. Khối lượng Fe thu được là
 Xem đáp án
Xem đáp án
Chọn C.
gam
Câu 13:
Ô nhiễm không khí có thể tạo ra mưa axit, gây ra tác hại rất lớn với môi trường. Hai khí nào sau đây đều là nguyên nhân gây ra mưa axit?
 Xem đáp án
Xem đáp án
Câu 14:
Phản ứng hóa học nào sau đây có phương trình ion rút gọn: Ca2+ + CO![]() → CaCO3?
→ CaCO3?
 Xem đáp án
Xem đáp án
Câu 17:
Polime nào sau đây được điều chế bằng phản ứng trùng ngưng?
 Xem đáp án
Xem đáp án
Câu 18:
Trong các ion kim loại sau đây, ion nào có tính oxi hóa yếu nhất?
 Xem đáp án
Xem đáp án
Câu 21:
Chất nào sau đây tác dụng với dung dịch KHCO3 sinh ra khí CO2?
 Xem đáp án
Xem đáp án
Câu 23:
Dung dịch của chất nào sau đây làm quỳ tím chuyển thành màu hồng?
 Xem đáp án
Xem đáp án
Câu 24:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Câu 25:
Chất X mạch hở có công thức phân tử C6H8O2. Từ X thực hiện các phản ứng sau:
(a) X + 2NaOH → Y + Z + H2O (t°)
(b) Y + H2SO4 → Na2SO4 + T
(c) Z + O2 → CH3COOH + H2O (enzim)
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn B.
là
(a) có tạo nên còn 1 chức axit.
là
Y là
T là
A. Sai
B. Đúng, T là
C. Sai, X có 2 cấu tạo:
D. Sai
Câu 26:
Cho các phát biểu sau:
(a) Vải làm từ chất liệu nilon-6,6 kém bền trong nước xà phòng có tính kiềm.
(b) Khi nấu canh cua, hiện tượng riêu cua nổi lên trên là do sự đông tụ protein.
(e) Một số este có mùi thơm được dùng làm chất tạo hương trong công nghiệp thực phẩm.
(d) Nếu nhỏ dung dịch I2 vào lát cắt của quả chuối xanh thì xuất hiện màu xanh tím.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn B.
(a) Đúng, do nhóm –CONH- dễ bị thủy phân trong kiềm.
(b) Đúng
(c) Đúng
(d) Đúng, chuối xanh có tinh bột, tạo màu xanh tím với I2.
Câu 27:
 Xem đáp án
Xem đáp án
Chọn A.
Muối
0,12…………….0,24……0,36
m muối
Câu 28:
Cho các chất: metylamin, xenlulozơ, vinyl axetat, glyxin, Gly-Ala. Số chất phản ứng được với NaOH trong dung dịch là
 Xem đáp án
Xem đáp án
Chọn C.
Có 3 chất phản ứng được với NaOH trong dung dịch là:
Vinyl axetat, glyxin, Gly-Ala.
Câu 29:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Câu 30:
Tiến hành các thí nghiệm sau:
(a) Sục khí CO2 dư vào dung dịch Ba(OH)2
(b) Cho dung dịch chứa a mol KHSO4 vào dung dịch chứa a mol NaHCO3
(c) Cho hỗn hợp BaO và Al2O3 (tỉ lệ mol 1:1) vào nước dư
(d) Cho hỗn hợp Fe3O4 và Cu (tỉ lệ mol 1:1) vào dung dịch HCl dư
(e) Cho dung dịch chứa 4a mol HCl vào dung dịch chứa a mol NaAlO2
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được dung dịch chứa một muối là
 Xem đáp án
Xem đáp án
Chọn B.
(a) dư
(b)
(c)
(d)
(e)
Câu 31:
Cho các chất: NaOH, Cu, HCl, HNO3, AgNO3, Mg. Số chất phản ứng được với dung dịch Fe(NO3)2 là
 Xem đáp án
Xem đáp án
Chọn C.
Các chất NaOH, HCl, HNO3, AgNO3, Mg có phàn ứng với
(Chung cho HCl và HNO3)
Câu 32:
Cho m gam tinh bột lên men thành ancol (rượu) etylic với hiệu suất 81%. Toàn bộ lượng CO2 sinh ra được hấp thụ hoàn toàn vào dung dịch Ca(OH)2, thu được 550 gam kết tủa và dung dịch X. Đun kỹ dung dịch X thu thêm được 100 gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn D.
Đun kỹ X thu thêm kết tủa chứng tỏ X chứa
tổng = 7,5
Câu 33:
Tinh thể chất rắn X không màu, vị ngọt, dễ tan trong nước. X có nhiều trong quả nho chín nên còn gọi là đường nho. Khử chất X bằng H2 thu được chất hữu cơ Y. Tên gọi của X và Y lần lượt là?
 Xem đáp án
Xem đáp án
Chọn A.
X có nhiều trong quả nhon chín nên còn gọi là đường nho là Glucozơ
nên Y là sobitol.
Câu 34:
Hỗn hợp T gồm ba este X, Y, Z mạch hở (MX < MY < MZ). Cho 48,28 gam T tác dụng vừa đủ với dung dịch chứa 0,47 mol NaOH, thu được một muối duy nhất của axit cacboxylic đơn chức và hỗn hợp Q gồm các ancol no, mạch hở, có cùng số nguyên tử cacbon trong phân tử. Đốt cháy hoàn toàn Q, thu được 13,44 lít khí CO2 và 14,4 gam H2O. Phần trăm khối lượng của nguyên tố H trong Y là
 Xem đáp án
Xem đáp án
Chọn D.
Đốt và
Số
Số O của ancol và
Bảo toàn khối lượng
M muối
nên các este là:
Câu 35:
Tiến hành các bước thí nghiệm như sau:
Bước 1: Cho một nhúm bông vào cốc đựng dung dịch H2SO4 70%, đun nóng đồng thời khuấy đều đến khi thu được dung dịch đồng nhất.
Bước 2: Trung hòa dung dịch thu được bằng dung dịch NaOH 10%.
Bước 3: Lấy dung dịch sau khi trung hòa cho vào ống nghiệm đựng dung dịch AgNO3/NH3, sau đó đun nóng.
Nhận định nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn D.
Bước 1:
Bước 2:
Bước 3:
A. Sai
B. Sai, thí nghiệm chứng minh xenlulozơ bị thủy phân trong axit.
C. Sai, chỉ có glucozơ.
D. Đúng
Câu 36:
Trong quá trình bảo quản, một mẫu muối FeSO4.7H2O (có khối lượng m gam) bị oxi hóa bởi oxi không khí tạo thành hỗn hợp X chứa các hợp chất của Fe(II) và Fe(III). Hòa tan toàn bộ X trong dung dịch loãng chứa 0,02 mol H2SO4, thu được 100 ml dung dịch Y. Tiến hành hai thí nghiệm với Y:
Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 25ml dung dịch Y, thu được 2,33 gam kết tủa.
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 25ml dung dịch Y, thu được dung dịch Z.
Nhỏ từ từ dung dịch KMnO4 0,04M vào Z đến khi phản ứng vừa đủ thì hết 22ml. Giá trị của m và phần trăm số mol Fe(II) đã bị oxi hóa trong không khí lần lượt là
 Xem đáp án
Xem đáp án
Chọn D.
(Chú ý: Các thí nghiệm chỉ dùng 1/4 dung dịch Y nên ta gấp 4 lần số liệu lên).
TN1: Bảo toàn S:
gam
TN2: Bảo toàn electron:
bị oxi hóa
bị oxi hóa
Câu 37:
 Xem đáp án
Xem đáp án
Chọn A.
Đặt u, v là số mol axit và triglyxerit.
Các axit có riêng triglyxerit có nên:
và
Bảo toàn khối lượng m muối
Câu 38:
Hòa tan hoàn toàn 8,976 gam hỗn hợp X gồm FeS2, FeS, Cu2S và Cu trong 864 ml dung dịch HNO3 1M đun nóng, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,186 mol một chất khí thoát ra. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu được 11,184 gam kết tủa. Mặt khác, dung dịch Y phản ứng tối đa với m gam Fe, biết trong các quá trình trên, sản phẩm khử duy nhất của NO![]() là NO. Giá trị của m là
là NO. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn A.
Quy đổi X thành
Bảo toàn electron:
và
Y chứa bảo toàn điện tích
Bảo toàn electron:
Câu 39:
Cho từ từ từng giọt dung dịch Ba(OH)2 loãng đến dư vào dung dịch chứa a mol Al2(SO4)3 và b mol Na2SO4. Khối lượng kết tủa (m gam) thu được phụ thuộc vào số mol Ba(OH)2 (n mol) được biểu diễn bằng đồ thị như hình sau:
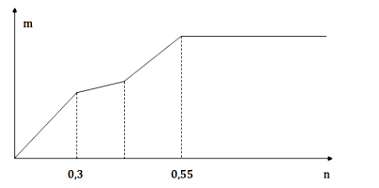
Giá trị tỉ lệ a : b tương ứng là
 Xem đáp án
Xem đáp án
Chọn D.
Đoạn 1:
Khi kết tủa không thay đổi thì dung dịch chứa
bảo toàn điện tích dư
dư
Chú ý:
Đoạn 2: Hòa tan hết
Đoạn 3: Kết tủa hết phần còn lại
Câu 40:
Hỗn hợp X gồm metyl amino axetat (NH2-CH2-COOCH3), axit glutamic và vinyl fomat. Hỗn hợp Y gồm etilen và metylamin. Để đốt cháy hoàn toàn x mol X và y mol Y thì tổng số mol O2 cần dùng vừa đủ là 2,28 mol, thu được H2O, 0,2 mol N2 và 1,82 mol CO2. Mặt khác, để phản ứng hết với x mol X cần vừa đủ V ml dung dịch KOH 2M, đun nóng. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn A.
Quy đổi hỗn hợp thành X, Y thành và
ml
