230 Bài tập thí nghiệm Hóa Học cực hay có đáp án(Đề số 1)
-
3069 lượt thi
-
35 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Hình vẽ mô tả thí nghiệm điều chế khí Z:
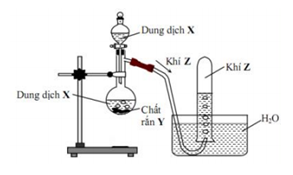
Phương trình hóa học điều chế khí Z là
 Xem đáp án
Xem đáp án
Khí Z là khí H2 vì khí này nhẹ hơn nước và không tan trong nước
Có thể thu khí H2 bằng phương pháp đẩy nước
Phương trình phản ứng thỏa mãn điều kiện là:
Zn + 2HCl(dung dịch) ZnCl2 + H2
Đáp án A
Câu 2:
Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ chất rắn X như sau:
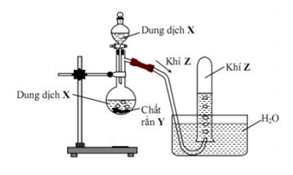
Hình vẽ trên minh họa cho phản ứng nào sau đây?
 Xem đáp án
Xem đáp án
Hình vẽ trên là thí nghiệm nung chất rắn X không phải là quá trình hòa tan X
→ loại D
Khí Y không tan trong nước nên loại B và C vì SO2, NH3 và HCl đều tan trong nước
Phản ứng A đúng
→ Đáp án A
Câu 3:
Cho hình vẽ mô tả thí nghiệm sau
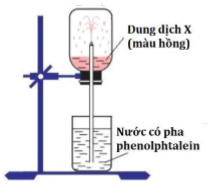
Hình vẽ trên mô tả thí nghiệm để chứng minh
 Xem đáp án
Xem đáp án
Hình vẽ trên mô tả thí nghiệm để chứng minh tính tan nhiều trong nước của NH3 vì amoniac tan nhiều trong nước làm giảm áp suất trong bình và nước bị hút vào bình. Ngoài ra NH3 có tính bazơ nên làm phenolphtalein chuyển thành màu hồng.
→ Đáp án C
Câu 4:
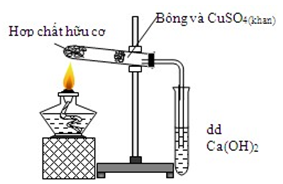
Cho hình vẽ mô tả qua trình xác định C và H trong hợp chất hữu cơ. Vai trò của CuSO4 (khan) và sự biến đổi của nó trong thí nghiệm.
 Xem đáp án
Xem đáp án
Sự biến đổi: 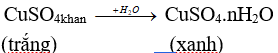
Vai trò: CuSO4 khan hút nước → chứng tỏ sản phẩm cháy chứa nước
xác định H trong hợp chất hữu cơ. → Đáp án B
Câu 5:
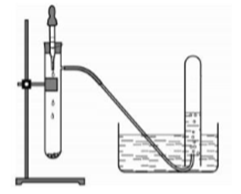
Hình vẽ dưới đây mô tả thí nghiệm điều chế khí X trong phòng thí nghiệm. X là khí nào trong các khí sau:
 Xem đáp án
Xem đáp án
Khí X không thể là NH3 và HCl vì hai khí này tan rất nhiều trong nước.
Với N2 muốn điều chế cần có nhiệt độ (nguồn nhiệt)
→Chỉ có CO2 hợp lý
Ví dụ: NaHCO3 + HCl → NaCl + CO2 + H2O
→ Đáp án B
Câu 6:
Đun nóng etanol với axit sunfuric đặc để thu được khí etilen
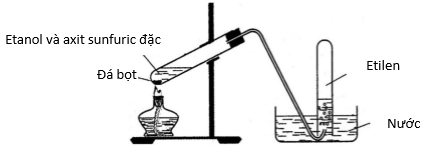
(sản phẩm chính) theo sơ đồ hình vẽ dưới đây.
Phát biểu nào sau đây là sai?
 Xem đáp án
Xem đáp án
Khí etilen được điều chế và được thu theo phương pháp dời nước nhằm hòa tan các khí tạo chất (khí sunfurơ, đietyl ete).
![]()
B. sai: Dung dịch nước brom sẽ giữ lại khí etilen, không thu được khí này:
CH2 = CH2 + Br2 → CH2Br – CH2Br
C. đúng: Nhiệt độ đèn cồn thường không thể ổn định, thường sinh ra đietyl ete:
![]()
D. đúng
Đáp án B
Câu 7:
Các chất khí X, Y, Z, T được điều chế trong phòng thí nghiệm và được thu theo đúng nguyên tắc theo các hình vẽ dưới đây.
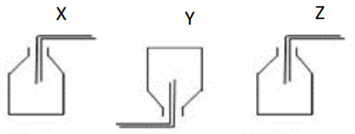
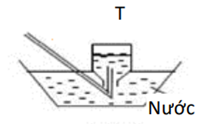
Nhận xét nào sau đây là đúng?
 Xem đáp án
Xem đáp án
NH3 tan tốt trong nước, không thu được khi sục qua nước → Loại A.
HCl (36,5) nặng hơn không khí (29), đặt đứng bình, dẫn khí từ trên xuống → B đúng.
CO2 (44) nặng hơn không khí (29), cần thu theo cách giống HCl → Loại C.
H2 nhẹ hơn không khí, đặt úp bình, dẫn khí từ dưới lên → Loại D.
→ Đáp án B
Câu 8:
Thực hiện phản ứng vôi tôi xút và thu khí metan theo sơ đồ hình vẽ dưới đây.
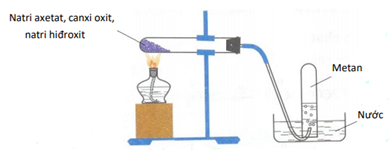
Phát biểu nào sau đây là không đúng?
 Xem đáp án
Xem đáp án
CH3COONa + NaOH CH4 + Na2CO3 (B, C đúng)
CH4 hầu như không tan trong nước nên được thu bằng phương pháp dời nước → A đúng
Khi thay H2O bằng nước vẫn thu được metan bởi CH4 không tác dụng với H2SO4 → D sai
→ Đáp án D
Câu 9:
Cho hình vẽ mô tả thí nghiệm bên.Đây là thí nghiệm điều chế và thu khí nào sau đây?
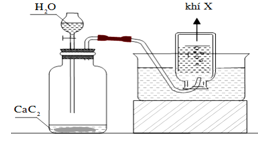
 Xem đáp án
Xem đáp án
Chọn A
Câu 10:
Thực hiện các thí nghiệm sau ở điều kiện thường:
(1) Cho bột nhôm vào bình khí clo.
(2) Sục khí H2S vào dung dịch FeSO4.
(3) Cho dung dịch Mg(NO3)2 vào dung dịch chứa FeSO4 và H2SO4 loãng.
(4) Cho Cr2O3 vào dung dịch NaOH loãng.
(5) Cho dung dịch BaCl2 vào dung dịch KHSO4.
(6) Cho CrO3 vào ancol etylic.
Số thí nghiệm xảy ra phản ứng là
 Xem đáp án
Xem đáp án
Chọn C.
(1) 2Al + 3Cl2 ® 2AlCl3.
(2) Sục khí H2S vào dung dịch FeSO4 : không có phản ứng xảy ra.
(3) 3Fe2+ + 4H+ + NO3– ® 3Fe3+ + NO + 2H2O.
(4) Cr2O3 không tác dụng với dung dịch NaOH loãng.
(5) BaCl2 + KHSO4 ® BaSO4 + KCl + HCl.
(6) 4CrO3 + C2H5OH ® 2Cr2O3 + 2CO2 + 3H2O
Câu 11:
Tiến hành thí nghiệm của một vài vật liệu polime với dung dịch kiềm theo các bước sau đây:
Bước 1: Lấy 4 ống nghiệm đựng lần lượt các chất PE, PVC, sợi len, xenlulozơ theo thứ tự 1, 2, 3, 4.
Bước 2: Cho vào mỗi ống nghiệm 2 ml dung dịch NaOH 10%, đun sôi rồi để nguội.
Bước 3: Gạt lấy lớp nước ở mỗi ống nghiệm ta được tương ứng các ống nghiệm 1', 2', 3', 4'.
Bước 4: Thêm HNO3 và vài giọt AgNO3 vào ống 1', 2'. Thêm vài giọt CuSO4 vào ống 3', 4'.
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Chọn D.
- Hiện tượng:
+ Ống 1’: không có hiện tượng gì
+ Ống 2’: xuất hiện kết tủa trắng
+ Ống 3’: xuất hiện màu tím đặc trưng
+ Ống 4’: không có hiện tượng
- Giải thích:
+ Ống 2’ xuất hiện kết tủa trắng do đã xảy ra các phản ứng:
(C2H3Cl)n + nNaOH → (C2H3OH)n + nNaCl
NaCl + AgNO3 → AgCl + NaNO3
NaOH + HNO3 → NaNO3 + H2O
+ Ống 3’: protein bị thủy phân tạo ra các amino axit, đipeptit, tripeptit…. Có phản ứng màu với Cu(OH)2.
Câu 12:
X, Y, Z, M là các kim loại. Thực hiện các thí nghiệm sau:

Chiều tăng dần tính khử của các kim loại X, Y, Z, M là
 Xem đáp án
Xem đáp án
Chọn D.
- Hiện tượng:
+ Ống 1’: không có hiện tượng gì
+ Ống 2’: xuất hiện kết tủa trắng
+ Ống 3’: xuất hiện màu tím đặc trưng
+ Ống 4’: không có hiện tượng
- Giải thích:
+ Ống 2’ xuất hiện kết tủa trắng do đã xảy ra các phản ứng:
(C2H3Cl)n + nNaOH → (C2H3OH)n + nNaCl
NaCl + AgNO3 → AgCl + NaNO3
NaOH + HNO3 → NaNO3 + H2O
+ Ống 3’: protein bị thủy phân tạo ra các amino axit, đipeptit, tripeptit…. Có phản ứng màu với Cu(OH)2.
Câu 14:
Cho hình vẽ bên mô tả thiết bị chưng cất thường. Vai trò của nhiệt kế trong khi chưng cất là
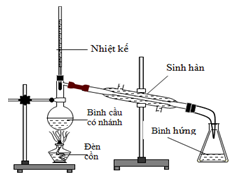
 Xem đáp án
Xem đáp án
Chọn C
Câu 15:
Thực hiện các thí nghiệm sau:
(1) Cho dung dịch HCl dư vào ống nghiệm chứa dung dịch NaAlO2.
(2) Dẫn khí CO2 dư vào ống nghiệm chứa dung dịch NaAlO2.
(3) Cho dung dịch Ba(OH)2 dư vào ống nghiệm chứa dung dịch Al2(SO4)3.
(4) Cho dung dịch NH3 dư vào ống nghiệm chứa dung dịch Al2(SO4)3.
(5) Cho dung dịch AgNO3 vào ống nghiệm chứa dung dịch HCl.
(6) Cho nước cứng vĩnh cửu tác dụng với dung dịch Na3PO4.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
Chọn D.
(1) HCl + NaAlO2 + H2O ® NaCl + Al(OH)3¯.
(2) CO2 + NaAlO2 + 2H2O ® NaHCO3 + Al(OH)3¯.
(3) 4Ba(OH)2 + Al2(SO4)3 ® 3BaSO4¯ + Ba(AlO2)2 + 4H2O.
(4) 6NH3 + 6H2O + Al2(SO4)3 ® 2Al(OH)3¯ + 3(NH4)2SO4.
(5) AgNO3 + HCl ® AgCl¯ + HNO3.
(6) Nước cứng vĩnh cửu (Ca2+, Mg2+, Cl-, SO42-) tác dụng với Na3PO4 có tạo thành kết tủa Ca3(PO4)2, Mg3(PO4)2 màu trắng.
Câu 16:
Tiến hành thí nghiệm với các chất X, Y, Z, T, kết quả được trình bày trong bảng dưới đây:
|
Thuốc thử |
X |
Y |
Z |
T |
|
Nước brom |
Không mất màu |
Mất màu |
Không mất màu |
Không mất màu |
|
Nước |
Tách lớp |
Tách lớp |
Dung dịch đồng nhất |
Dung dịch đồng nhất |
|
Dung dịch AgNO3/NH3 |
Không có kết tủa |
Không có kết tủa |
Có kết tủa |
Không có kết tủa |
Các chất X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Chọn C
Câu 17:
Có 2 dung dịch X,Y loãng, mỗi dung dịch chứa một chất tan và có số mol bằng nhau. Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho bột Fe dư vào dung dịch X, thu được a mol một chất khí duy nhất không màu, hoá nâu trong không khí.
- Thí nghiệm 2: Cho bột Fe dư dung dịch Y, thu được 2a mol một chất khí duy nhất không màu, không hoá nâu trong không khí.
- Thí nghiệm 3: Trộn dung dịch X với dung dịch Y rồi thêm bột Fe đến dư, thu được 2a mol một chất khí duy nhất không màu, hoá nâu trong không khí.
Biết các phản ứng xảy ra hoàn toàn và chỉ tạo muối của kim loại. Hai dung dịch X, Y lần lượt là
 Xem đáp án
Xem đáp án
Chọn C.
Hai dung X, Y phải là hai axit Þ Loại D.
Dung dịch X tác dụng với Fe dư, thu được khí không màu hoá nâu trong không khí là NO Þ Loại A.
Theo đề lượng khí thoát ra ở thí nghiệm 2 gấp đôi thí nghiệm 1 nên X, Y chỉ có thể là HNO3, NaHSO4.
Câu 18:
Hình vẽ bên mô tả thu khí X trong phòng thí nghiệm.
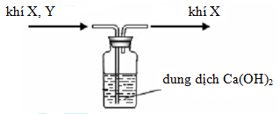
Khí X và Y có thể lần lượt là những khí nào sau đây?
 Xem đáp án
Xem đáp án
Chọn C
Câu 19:
Thực hiện các thí nghiệm sau:
(a) Nhúng thanh Fe nguyên chất vào dung dịch CuSO4.
(b) Cho bột Fe vào dung dịch HNO3 đặc, nguội.
(c) Đốt cháy dây kim loại Fe trong khí Cl2.
(d) Cho hợp kim Fe-Cu vào dung dịch H2SO4 loãng.
(e) Nhúng miếng tôn (Fe-Zn) vào dung dịch muối ăn.
Số thí nghiệm xảy ra ăn mòn kim loại là
 Xem đáp án
Xem đáp án
Chọn D
Câu 20:
Thực hiện các thí nghiệm sau:
(1) Cho hỗn hợp gồm 2a mol Na và a mol Al vào lượng nước dư.
(2) Cho a mol bột Cu vào dung dịch chứa a mol Fe2(SO4)3.
(3) Cho dung dịch chứa a mol KHSO4 vào dung dịch chứa a mol KHCO3.
(4) Cho dung dịch chứa a mol BaCl2 vào dung dịch chứa a mol CuSO4.
(5) Cho dung dịch chứa a mol Fe(NO3)2 vào dung dịch chứa a mol AgNO3.
(6) Cho a mol Na2O vào dung dịch chứa a mol CuSO4.
Sau khi kết thúc thí nghiệm, số trường hợp thu được dung dịch chứa hai muối là
 Xem đáp án
Xem đáp án
Chọn D.
Có 1 thí nghiệm thu được dung dịch hai muối là (2)
(1) Na + H2O ® NaOH + 1/2H2 rồi NaOH + Al + H2O ® NaAlO2 + 3/2H2.
Dung dịch thu được gồm NaOH dư và NaAlO2 (có chứa 1 muối).
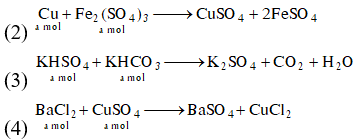 (BaSO4 kết tủa không tồn tại trong dung dịch)
(BaSO4 kết tủa không tồn tại trong dung dịch)
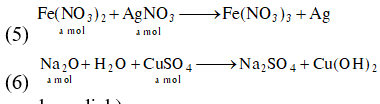 (Cu(OH)2 kết tủa không tồn tại trong dung dịch)
(Cu(OH)2 kết tủa không tồn tại trong dung dịch)
Câu 21:
Kết quả thí nghiệm của các dung dịch X, Y, Z với thuốc thử được ghi ở bảng sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Dung dịch Na2SO4 dư |
Kết tủa trắng |
|
Y |
Dung dịch X dư |
Kết tủa trắng tan trong dung dịch HCl dư |
|
Z |
Dung dịch X dư |
Kết tủa trắng không tan trong dung dịch HCl dư |
Dung dịch X, Y, Z lần lượt là
 Xem đáp án
Xem đáp án
Chọn B.
X + Na2SO4 → Kết tủa trắng ⇒ Loại C vì không tạo ↓.
Y + X → Kết tủa có thể tan trong HCl ⇒ Loại D vì ↓ là BaSO4.
Z + X → Kết tủa không tan trong HCl ⇒ Loại A vì ↓ là Mg(OH)2.
Câu 22:
Cho một ít lòng trắng trứng vào 2 ống nghiệm:
|
Ống (1): thêm vào một ít nước rồi đun nóng. |
Ống (2): thêm vào một ít rượu rồi lắc đều. |
Hiện tượng quan sát được tại 2 ống nghiệm là
 Xem đáp án
Xem đáp án
Chọn B
Câu 23:
Hình vẽ bên mô tả thí nghiệm tính tan của chất X trong nước. Hiện tượng quan sát được là nước từ chậu phun vào bình đựng khí X thành những tia màu đỏ. X là
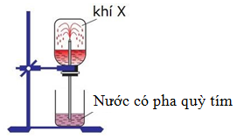
 Xem đáp án
Xem đáp án
Chọn B
Câu 24:
Kết quả thí nghiệm của các chất hữu cơ X, Y, Z như sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Cu(OH)2 ở nhiệt độ thường |
Dung dịch xanh lam |
|
Y |
Nước brom |
Mất màu dung dịch Br2 |
|
Z |
Quỳ tím |
Hóa xanh |
Các chất X, Y, Z lần lượt là
 Xem đáp án
Xem đáp án
Chọn D
Câu 25:
Tiến hành các thí nghiệm sau:
(a) Cho kim loại Cu dư vào dung dịch Fe(NO3)3.
(b) Sục khí CO2 dư vào dung dịch KOH.
(c) Cho Na2CO3 vào dung dịch Ca(HCO3)2 (tỉ lệ mol 1 : 1).
(d) Cho bột Fe vào dung dịch FeCl3 dư.
(e) Cho hỗn hợp BaO và Al2O3 (tỉ lệ mol 1 : 1) vào nước dư.
(f) Cho hỗn hợp Fe2O3 và Cu (tỉ lệ mol 1 : 1) vào dung dịch HCl dư.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được dung dịch chứa một chất tan là
 Xem đáp án
Xem đáp án
Chọn B.
(a) Cu dư + Fe(NO3)3 ® Cu(NO3)2 + Fe(NO3)2.
(b) CO2 dư + KOH ® KHCO3.
(c) Na2CO3 + Ca(HCO3)2 ® CaCO3 + 2NaHCO3.
(d) Fe + 2FeCl3 dư ® 3FeCl2.
(e) BaO + H2O ® Ba(OH)2 sau đó Al2O3 + Ba(OH)2 ® Ba(AlO2)2 + H2O.
(f) Fe2O3 + 6HCl dư ® 2FeCl3 + 3H2O sau đó 2FeCl3 + Cu ® 2FeCl2 + CuCl2.
Vậy có 3 thí nghiệm thoả mãn là (b), (c), (e).
Câu 26:
Tiến hành thí nghiệm phản ứng xà phòng hóa theo các bước sau đây:
Bước 1: Cho 1 gam mỡ, 2 ml NaOH 40% vào bát sứ.
Bước 2: Đun sôi nhẹ hỗn hợp khoảng 30 phút đồng thời khuấy đều. Thỉnh thoảng thêm vài giọt nước cất.
Bước 3: Để nguội hỗn hợp, sau đó rót 10 ml dung dịch NaCl bão hòa vào hỗn hợp, khuấy nhẹ rồi giữ yên hỗn hợp.
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn C.
A. Sai, Mục đích chính của việc thêm dung dịch NaCl bão hòa là tách lớp xà phòng (ở trên) và glixerol.
B. Sai, Sau bước 2, chất lỏng trong bát sứ trở nên đồng nhất.
D. Sai, NaOH có vai trò làm chất xúc tác và chất tham gia cho phản ứng trên.
Câu 27:
Có ba dung dịch riêng biệt: HCl 1M; Fe(NO3)2 1M; FeCl2 1M được đánh số ngẫu nhiên là (1), (2), (3). Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho dung dịch AgNO3 dư vào V ml dung dịch (1) thu được m1 gam kết tủa.
- Thí nghiệm 2: Cho dung dịch AgNO3 dư vào V ml dung dịch (2) thu được m2 gam kết tủa.
- Thí nghiệm 3: Cho dung dịch AgNO3 dư vào V ml dung dịch (3) thu được m3 gam kết tủa.
Biết các phản ứng xảy ra hoàn toàn và m1 < m2 < m3. Hai dung dịch (1) và (3) lần lượt là
 Xem đáp án
Xem đáp án
(a) Fe(NO3)2 + AgNO3 ® Fe(NO3)3 + Ag
(b) HCl + AgNO3 ® AgCl + HNO3
(c) FeCl2 + AgNO3 ® Fe(NO3)3 + AgCl + Ag
Tại phản ứng (c) kết tủa thu được là lớn nhất Þ (3) là dung dịch FeCl2.
Tại phản ứng (a) kết tủa thu được là nhỏ nhất Þ (1) là dung dịch Fe(NO3)2.
Vậy dung dịch (2) là HCl.
Chọn D
Câu 28:
Cho các bước để tiến hành thí nghiệm tráng bạc bằng anđehit fomic:
(1) Nhỏ tiếp 3-5 giọt dung dịch HCHO vào ống nghiệm.
(2) Nhỏ từ từ từng giọt dung dịch NH3 2M cho đến khi kết tủa sinh ra bị hòa tan hết.
(3) Đun nóng nhẹ hỗn hợp ở 60-70oC trong vài phút.
(4) Cho 1 ml dung dịch AgNO3 1% vào ống nghiệm sạch.
Thứ tự tiến hành đúng là
 Xem đáp án
Xem đáp án
Chọn C.
Các bước tiến hành thí nghiệm trên là:
(4) Cho 1 ml dung dịch AgNO3 1% vào ống nghiệm sạch.
(2) Nhỏ từ từ từng giọt dung dịch NH3 2M cho đến khi kết tủa sinh ra bị hòa tan hết.
(1) Nhỏ tiếp 3-5 giọt dung dịch HCHO vào ống nghiệm.
(3) Đun nóng nhẹ hỗn hợp ở 60-70oC trong vài phút.
Câu 29:
Tiến hành các thí nghiệm sau:
(1) Cho miếng kẽm vào dung dịch HCl loãng, có nhỏ thêm vài giọt CuSO4.
(2) Đốt dây thép trong bình đựng đầy khí oxi.
(3) Cho lá thép vào dung dịch ZnSO4.
(4) Cho lá nhôm vào dung dịch CuSO4.
Số trường hợp xảy ra sự ăn mòn điện hóa là
 Xem đáp án
Xem đáp án
Chọn D
Câu 30:
Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong khí clo.
(2) Đốt cháy hỗn hợp sắt và lưu huỳnh (trong điều kiện không có không khí).
(3) Cho sắt (II) oxit vào dung dịch axit sunfuric đặc nóng.
(4) Cho sắt vào dung dịch đồng (II) sunfat.
(5) Cho đồng vào dung dịch sắt (III) clorua.
(6) Cho oxit sắt từ tác dụng với dung dịch axit clohidric.
Số thí nghiệm tạo ra muối sắt (II) là
 Xem đáp án
Xem đáp án
Chọn A.
(1) 2Fe + 3Cl2 2FeCl3
(2) Fe + S FeS
(3) 2FeO + 4H2SO4(đặc, nóng) Fe2(SO4)3 + SO2 + 4H2O
(4) Fe + CuSO4FeSO4 + Cu
(5) Cu + 2FeCl3 CuCl2 + 2FeCl2
(6) Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O
Câu 31:
Thực hiện các thí nghiệm sau
(1) Nhúng thanh Fe nguyên chất vào dung dịch hỗn hợp NaNO3 và HCl.
(2) Nhúng thanh Fe nguyên chất vào dung dịch FeCl3.
(3) Nhúng thanh Fe nguyên chất vào dung dịch CuCl2.
(4) Nối thanh nhôm với thanh đồng, để ngoài không khi ẩm.
Số trường hợp xảy ra ăn mòn điện hóa học là
 Xem đáp án
Xem đáp án
Điều kiện xảy ra ăn mòn điện hóa là tồn tại 2 điện cực khác bản chất, tiếp xúc với nhau và nhúng trong cùng 1 dung dịch chất điện ly.
Vậy các thi nghiệm đúng là 3 (sinh ra Cu), 4.
=> Chọn đáp án C.
Câu 32:
Tiến hành các thí nghiệm sau:
(a) Điện phân dung dịch muối ăn với điện cực trơ, có màng ngăn xốp.
(b) Thổi khí CO qua ống đựng FeO nung nóng ở nhiệt độ cao.
(c) Sục khí H2S vào dung dịch FeCl3.
(d) Dẫn khí NH3 vào bình khí Cl2.
(e) Sục khí CO2 vào dung dịch Na2CO3.
Số thí nghiệm có sinh ra đơn chất là:
 Xem đáp án
Xem đáp án
Xét từng thí nghiệm:
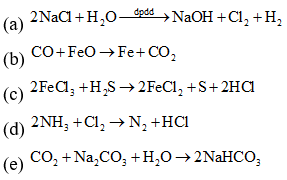
Các thí nghiệm sinh ra đơn chất: (a) (b) (c) (d).
Số thí nghiệm sinh ra đơn chất là 4.
=>Chọn đáp án A.
Câu 33:
Tiến hành thí nghiệm với các chất X, Y, Z, T. Kết quả thu được ghi ở bảng sau:
|
Chất |
Thí nghiệm |
Hiện tượng |
|
X |
Tác dụng Cu(OH)2 / OH- |
Có màu tím |
|
Y |
Đun nóng với dung dịch NaOH (loãng; dư) để nguội. Thêm tiếp vài giọt dung dịch CuSO4 |
Tạo dung dịch màu xanh tam |
|
Z |
Đun nóng với dung dịch NaOH loãng (vừa đủ). Thêm tiếp dung dịch AgNO3 trong NH3, đun nóng |
Tạo kểt tủa Ag |
|
T |
Tác dụng với dung dịch I2 loãng |
Có màu xanh tím |
Các chất X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Xét lần lượt từng chất:
+) X tác dụng Cu(OH)2/OH- có màu tím đặc trưng là phản ứng màu biure. X là lòng trắng trứng.
Loại đáp án A, D.
+) T tác dụng I2 tạo dung dịch xanh tím T là hồ tinh bột.
Loại đáp án C.
Chọn đáp án B.
Câu 34:
Tiến hành các thí nghiệm sau:
(a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng;
(b) Đốt dây Fe trong bình đựng khí O2;
(c) Cho lá Cu vào dung dịch gồm Fe(NO3) 3 và HNO3;
(d) Cho lá Zn vào dung dịch HCl;
Số thí nghiệm có xảy ra ăn mòn điện hóa là
 Xem đáp án
Xem đáp án
Điều kiện xảy ra ăn mòn điện hóa:
- Các điện cực phải khác nhau về bản chất hóa học (1)
- Các điện cực phải tiếp xúc với nhau (trực tiếp hoặc gián tiếp (2).
- Các điện cực phải cùng tiếp xúc với dug dịch chất điện li (3).
=> (a) là thỏa mãn cả 3 điều kiện trên.
(b) vi phạm cả 3 điều kiện trên, (c) vi phạm điều kiện (1), (2); d) vi phạm điều kiện (1), (2).
=> Chọn đáp án C.
Câu 35:
Tiến hành các thí nghiệm sau :
(1) Cho dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
(2) Cho dung dịch AgNO3 vào dung dịch H3PO4.
(3) Cho dung dịch NaHCO3 vào dung dịch MgCl2.
(4) Cho dung dịch Na3PO4 vào dung dịch Ca(NO3) 2.
(5) Cho dung dịch H2SO4 vào dung dịch Ba(HCO3)2.
Số thí nghiệm thu được kết tủa sau khi các phản ứng xảy ra hoàn toàn là
 Xem đáp án
Xem đáp án
Các thí nghiệm cho kết tủa:
Thí nghiệm 1: 4Ba(OH)2 dư + Al2(SO4)3 3BaSO4+ Ba(AlO2)2 + 4H2O
Thí nghiệm 2: không phản ứng. Lưu ý: Ag3PO4 tan trong axit mạnh !
Thí nghiệm 3: không phản ứng.
Thí nghiệm 4: ![]()
Thí nghiệm 5: ![]()
Chọn đáp án C.
