230 Bài tập thí nghiệm Hóa Học cực hay có đáp án(Đề số 2)
-
3074 lượt thi
-
35 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Tiến hành các thí nghiệm sau với dung dịch X chứa lòng trắng trứng:
- Thí nghiệm 1: Đun sôi dung dịch X.
- Thí nghiệm 2: Cho dung dịch HCl vào dung dịch X, đun nóng.
- Thí nghiệm 3: Cho dung dịch CuSO4 vào dung dịch X, sau đó nhỏ vài giọt dung dịch NaOH vào.
- Thí nghiệm 4: Cho dung dịch NaOH vào dung dịch X, đun nóng.
- Thí nghiệm 5: Cho dung dịch AgNO3 trong NH3 vào dung dịch X, đun nóng.
Số thí nghiệm có xảy ra phản ứng hóa học là
 Xem đáp án
Xem đáp án
Chọn A.
- Thí nghiệm 1: Xảy ra hiện tượng đông tụ (đây là một hiện tượng vật lý).
- Thí nghiệm 2: Xảy ra phản ứng thủy phân peptit trong môi trường axit.
- Thí nghiệm 3: Xảy ra phản ứng màu biure.
- Thí nghiệm 4: Xảy ra phản ứng thủy phân peptit trong môi trường bazơ.
- Thí nghiệm 5: Không xảy ra phản ứng.
Câu 2:
Hình vẽ sau mô tả thí nghiệm điều chế và thử tính chất của khí X như hình vẽ bên. Nhận xét nào sau đây sai?

 Xem đáp án
Xem đáp án
Chọn D.
Phản ứng: ![]()
+ Đá bọt giúp chất lỏng sôi ổn định và không gây vỡ ống nghiệm.
+ Bông tẩm NaOH đặc có tác dụng hấp thụ tạp chất khí sinh ra trong quá trình thí nghiệm.
+ Để thu được khí etilen ta phải đun hỗn hợp chất lỏng tới nhiệt độ 170oC – 180oC.
+ Etilen sinh ra sục vào ống nghiệm đựng dung dịch Br2 ® nhạt màu.
Câu 3:
Cho hình vẽ mô tả thí nghiệm điều chế và thử tính chất của hợp chất hữu cơ. Phản ứng xảy ra trong ống nghiệm A là
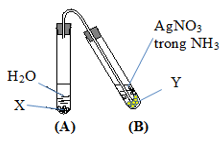
 Xem đáp án
Xem đáp án
Chọn B
Câu 4:
Thực hiện các thí nghiệm sau:
(a) Sục khí CO2 đến dư vào dung dịch NaAlO2.
(b) Cho dung dịch NaOH đến dư vào dung dịch AlCl3.
(c) Cho dung dịch NH3 đến dư vào dung dịch AlCl3.
(d) Cho dung dịch HCl đến dư vào dung dịch NaAlO2.
(e) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
(f) Cho BaCO3 vào lượng dư dung dịch NaHSO4.
Sau khi kết thúc thí nghiệm, số trường hợp thu được kết tủa là
 Xem đáp án
Xem đáp án
Chọn C.
(a) ![]()
(b) 4NaOH + AlCl3 → 3NaCl + NaAlO2 + 2H2O
(c) 3NH3 + AlCl3 + 3H2O → 3NH4Cl + Al(OH)3↓
(d) 4HCl(dư) + NaAlO2 → NaCl + AlCl3 + 2H2O
(e) Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓
(f) BaCO3 + 2NaHSO4 → BaSO4↓ + Na2SO4 + CO2 + H2O
Câu 5:
Hòa tan hoàn toàn hai chất rắn X, Y (có số mol bằng nhau) vào nước thu được dung dịch Z.
Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho dung dịch HCl dư vào V ml dung dịch Z, thu được V1 lít khí .
- Thí nghiệm 2: Cho dung dịch HNO3 dư vào V ml dung dịch Z, thu được V2 lít khí.
- Thí nghiệm 3: Cho dung dịch NaNO3 và HCl dư vào V ml dung dịch Z, thu được V2 lít khí.
Biết các phản ứng xảy ra hoàn toàn và V1 < V2 và sản phẩm khử duy nhất của N+5 là NO. Hai chất X, Y lần lượt là
 Xem đáp án
Xem đáp án
Chọn B.
Dựa vào đáp án thì chỉ có B là thoả mãn điều kiện V1 < V2.
Câu 6:
Tiến hành thí nghiệm với 3 chậu nước như hình vẽ sau:
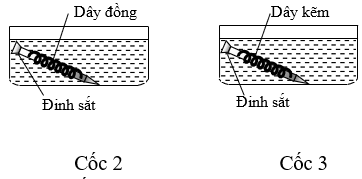
Đinh sắt trong cốc nào bị ăn mòn nhanh nhất?
 Xem đáp án
Xem đáp án
Chọn C
Câu 7:
Tiến hành thí nghiệm với các chất X, Y, Z, T (trong dung dịch) thu được các kết quả như sau:
|
Mẫu thử |
Thí nghiệm |
Hiện tượng |
|
X hoặc T |
Tác dụng với quỳ tím |
Quỳ tím chuyên màu xanh |
|
Y |
Tác dụng với dung dịch AgNO3/NH3 đun nóng
|
Có kết tủa Ag |
|
Z |
Không hiện tượng |
|
|
Y hoặc Z |
Tác dụng với Cu(OH)2 trong môi trường kiêm |
Dung dịch xanh lam |
|
T |
Có màu tím |
Biết T là chất hữu cơ mạch hở. Các chất X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Chọn B
Câu 8:
Thực hiện các thí nghiệm sau:
(1) Cho kim loại K vào dung dịch HCl.
(2) Đốt bột Al trong khí Cl2.
(3) Cho Na2CO3 vào dung dịch AlCl3.
(4) Cho NaOH vào dung dịch Mg(NO3)2.
(5) Điện phân Al2O3 nóng chảy, có mặt Na3AlF6.
(6) Cho FeCl2 tác dụng với dung dịch AgNO3 dư.
Số thí nghiệm có phản ứng oxi hoá – khử xảy ra là
 Xem đáp án
Xem đáp án
Chọn C.
(1) 2K + 2HCl ® 2KCl + H2.
(2) 2Al + 3Cl2 ® 2AlCl3
(3) 3Na2CO3 + 2AlCl3 + 3H2O ® 2Al(OH)3 + 3CO2 + 6NaCl.
(4) 2NaOH + Mg(NO3)2 ® Mg(OH)2 + NaNO3.
![]()
(6) FeCl2 + 3AgNO3 ® Fe(NO3)3 + 2AgCl + Ag.
Câu 9:
Trong phòng thí nghiệm, khí Z (làm mất màu dung dịch thuốc tím) được điều chế từ chất rắn X, dung dịch Y đặc, đun nóng và thu vào bình tam giác bằng phương pháp đẩy không khí như hình vẽ sau:

Các chất X, Y, Z lần lượt là
 Xem đáp án
Xem đáp án
Chọn B
Câu 10:
Thực hiện các thí nghiệm sau:
(1) Nung hỗn hợp Fe và KNO3 trong khí trơ. (2) Cho luồng khí H2 đi qua bột CuO nung nóng.
(3) Đốt dây Mg trong bình kín chứa đầy CO2. (4) Nhúng dây Ag vào dung dịch HNO3 loãng.
(5) Cho K2Cr2O7 vào dung dịch KOH. (6) Dẫn khí NH3 qua CrO3 đun nóng.
Số thí nghiệm xảy ra phản ứng oxi hóa - khử là
 Xem đáp án
Xem đáp án
Chọn B.
(1) 2KNO3 2KNO2 + O2
(2) H2 + CuO Cu + H2O
(3) 2Mg + CO2 2MgO + C
(4) 3Ag + 4HNO3 ® 3AgNO3 + NO + 2H2O
(5) K2Cr2O7 + 2KOH ® 2K2CrO4 + H2O
(6) 2NH3 + 2CrO3 N2 + Cr2O3 + 3H2O
Câu 11:
Tiến hành thí nghiệm với các dung dịch X, Y, Z và T. Kết quả được ghi ở bảng sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
Y |
Dung dịch KOH dư, đun nóng. Sau đó để nguội và thêm tiếp CuSO4 vào. |
Dung dịch có màu xanh lam. |
|
X |
AgNO3 trong dung dịch NH3 |
Tạo kết tủa Ag. |
|
Z |
Dung dịch Br2 |
Kết tủa trắng. |
|
T |
Quỳ tím |
Quỳ tím chuyển màu đỏ |
|
X, Y |
Dung dịch Br2 |
Mất màu |
Các chất X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Chọn C
Câu 12:
Cho X, Y, Z và T là các chất khác nhau trong số bốn chất sau đây: C2H5NH2, NH3, C6H5OH (phenol), C6H5NH2 (anilin) và các tính chất được ghi trong bảng sau:
|
Chất |
X |
Y |
Z |
T |
|
Nhiệt độ sôi (oC) |
182,0 |
-33,4 |
16,6 |
184,0 |
|
pH (dung dịch nồng độ 0,1 mol/l) |
8,8 |
11,1 |
11,9 |
5,4 |
Nhận xét nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Chọn A
Câu 13:
Hình vẽ sau đây mô tả thí nghiệm điều chế và thu khí Y từ hỗn hợp rắn gồm CaCO3 và CaSO3:
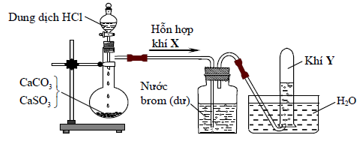
Khí Y là
 Xem đáp án
Xem đáp án
Chọn C.
Hỗn hợp khí X gồm CO2, SO2 được dẫn qua bình được nước brom Þ SO2 bị hấp thụ, khí CO2 thu được tạo ống nghiệm thu (CO2 ít tan trong nước).
Câu 14:
Cho 3 thí nghiệm sau:
(1) Cho từ từ dung dịch AgNO3 đến dư vào dung dịch Fe(NO3)2.
(2) Cho bột sắt từ từ đến dư vào dung dịch FeCl3.
(3) Cho từ từ dung dịch AgNO3 đến dư vào dung dịch FeCl3.
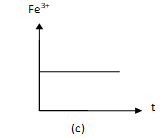
Trong mỗi thí nghiệm, số mol ion Fe3+ biến đổi tương ứng với đồ thị nào sau đây

 Xem đáp án
Xem đáp án
Chọn B.
- Đồ thị (a) cho thấy lượng Fe3+ từ 0 tăng dần sau đó không đổi nên ứng với thí nghiệm (1).
+ Phương trình phản ứng ![]()
+ Phương trình phản ứng : ![]()
- Đồ thị (c) cho thấy lượng Fe3+ không đổi nên ứng với phản ứng (3).
+ Phương trình phản ứng : ![]()
Câu 15:
Cho hình vẽ bên mô tả thí nghiệm điều chế khí Y từ dung dịch X. Hình vẽ minh họa phản ứng nào sau đây?

 Xem đáp án
Xem đáp án
Chọn A
Câu 16:
Tiến hành các thí nghiệm sau:
(a) Sục khí NH3 tới dư vào dung dịch FeSO4.
(b) Sục khí CO2 tới dư vào dung dịch Ba(AlO2)2.
(c) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
(d) Cho hỗn hợp rắn gồm Na2O và Al2O3 (tỉ lệ mol 1 : 1) vào nước dư.
(e) Cho dung dịch NaAlO2 tới dư vào dung dịch HCl.
(g) Cho hỗn hợp bột Cu và Fe2(SO4)3 (tỉ lệ mol 1 : 1) vào nước dư.
Sau khi phản ứng kết thúc, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
Chọn C.
(a) 2NH3 + FeSO4 + 2H2O ® Fe(OH)2¯ + (NH4)2SO4.
(b) 2CO2 + Ba(AlO2)2 + 4H2O ® 2Al(OH)3¯ + Ba(HCO3)2.
(c) Fe(NO3)2 + 3AgNO3 ® Fe(NO3)3 + 3Ag¯.
(d) Na2O + H2O ® 2NaOH sau đó Al2O3 + 2NaOH ® 2NaAlO2 + H2O (vừa đủ).
(e) NaAlO2 dư + HCl + H2O ® NaCl + Al(OH)3¯.
(g) Cu + Fe2(SO4)3 ® CuSO4 + 2FeSO4 (vừa đủ).
Câu 18:
Cho thí nghiệm như hình vẽ:

Thí nghiệm trên dùng để định tính nguyên tố nào có trong glucozơ
 Xem đáp án
Xem đáp án
Chọn B.
Dung dịch nước vôi trong nhận biết CO2 chứng minh hợp chất đốt cháy có C
CuSO4 khan nhận biết H2O chứng minh hợp chất có H
Câu 19:
Cho từ từ chất X vào dung dịch Y, sự biến thiên lượng kết tủa Z tạo thành trong thí nghiệm được biểu diễn trên đồ thị sau:

Phát biểu sau đây đúng là
 Xem đáp án
Xem đáp án
Chọn C.
Khi cho X là NaOH vào Y là dung dịch gồm HCl, AlCl3 hay Y là AlCl3hay cho CO2 vào Ca(OH)2 thì không thể có 1 đoạn kết tủa = const mà khi đạt max sẽ giảm luôn
Câu 20:
Tiến hành các thí nghiệm sau :
(1) Thuỷ phân tinh bột thu được hợp chất A
(2) Lên men giấm ancol etylic thu được hợp chất hữu cơ B
(3) Hyđrat hoá etylen thu được hợp chất hữu cơ D.
(4) Hấp thụ C2H2 vào dung dịch HgSO4 ở 800C thu được hợp chất hữu cơ E.
Chọn sơ đồ phản ứng đúng biểu diễn mối liên hệ giữa các chất trên. Biết mỗi mũi tên là một phản ứng
 Xem đáp án
Xem đáp án
Chọn A
Câu 21:
Các dung dịch riêng biệt: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số ngẫu nhiên (1), (2), (3), (4), (5). Tiến hành một số thí nghiệm, kết quả được ghi lại trong bảng sau:
|
Dung dịch |
(1) |
(2) |
(4) |
(5) |
|
(1) |
|
Khí thoát ra |
Có kết tủa |
|
|
(2) |
Khí thoát ra |
|
Có kết tủa |
Có kết tủa |
|
(4) |
Có kết tủa |
Có kết tủa |
|
|
|
(5) |
|
Có kết tủa |
|
|
Các dung dịch (1), (3), (5) lần lượt là
 Xem đáp án
Xem đáp án
Chọn A.
(1) Thủy phân tinh bột thu được glucozơ (A)
(2) C2H5OH + O2 → CH3COOH (B) + H2O
(3) CH2=CH2 + H2O → C2H5OH (D)
(4) C2H2 + H2O (xt HgSO4, t0) → CH3CHO (E)
Nên ta có sơ đồ chuyển hóa: A → D → E → B
C6H12O6 (lên men, xt) → 2CO2 + 2C2H5OH
C2H5OH + CuO → CH3CHO + Cu + H2O
2CH3CHO + O2 → 2CH3COOH
Câu 22:
Tiến hành các thí nghiệm sau:
(a) Đun sôi nước cứng toàn phần.
(b) Sục khí CO2 vào dung dịch nước thủy tinh (hay thủy tinh lỏng).
(c) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2
(d) Dẫn khí etilen qua dung dịch KMnO4.
(e) Cho Al4C3 vào dung dịch NaOH dư.
(g) Cho một lượng phân nitrophotka vào dung dịch nước vôi trong dư.
Sau khi thí nghiệm kết thúc, số trường hợp thu được kết tủa là
 Xem đáp án
Xem đáp án
Chọn A
Các thí nghiệm: a, b, c, d, g.
TN a: CaCO3, MgCO3.
TN b: SiO2.
TN c: Ag.
TN d: MnO2.
TN e: Al4C3 + NaOH + H2O → NaAl(OH)4 + CH4.
TN g: Ca3(PO4)2
Câu 23:
Chuẩn bị 4 ống nghiệm riêng biệt, đánh số thứ tự 1, 2, 3, 4 và tiến hành thí nghiệm theo các bước sau đây:
Ø Bước 1: Cho lần lượt nước ép quả nho chín, nước mía, nước vo gạo vào các ống nghiệm 1, 2, 3 tương ứng.
Ø Bước 2: Cho vào ống nghiệm số 4 vài giọt dung dịch CuSO4 0,5%, thêm tiếp 1 ml dung dịch NaOH 10%. Gạn bỏ phần dung dịch dư, giữ lại kết tủa.
Ø Bước 3: Cho kết tủa vào các ống nghiệm 1, 2, 3, lắc nhẹ và quan sát.
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Chọn A
Chỉ có ống nghiệm 1 có kết tủa trắng bạc, là ống nghiệm đựng nước ép quả nho chín.
+) Nước ép quả nho chín: có glucozơ.
+) Nước mía: có saccarozơ.
+) Nước vo gạo: có tinh bột
Câu 24:
Cho hình vẽ thiết bị chưng cất thường:
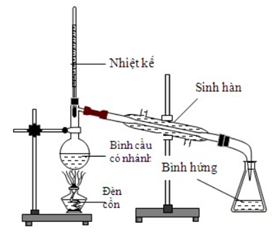
Vai trò của nhiệt kế trong khi chưng cất là
 Xem đáp án
Xem đáp án
Chọn C.
Phương pháp chưng cất dùng để tách các chất lỏng có nhiệt độ sôi khác nhau nhiều. Đun sôi một hỗn hợp lỏng, chất nào có nhiệt độ sôi thấp sẽ chuyển thành hơi sớm hơn và nhiều hơn. Ta dùng nhiệt kế đo nhiệt độ sôi của chất lỏng đang chưng cất phát hiện thời điểm thích hợp để thu chất
Câu 25:
Thực hiện các thí nghiệm sau ở nhiệt độ thường:
(a) Cho bột Al vào dung dịch NaOH. (b) Cho bột Fe vào dung dịch AgNO3.
(c) Cho CaO vào nước. (d) Cho dung dịch Na2CO3 vào dung dịch CaCl2.
Số thí nghiệm có xảy ra phản ứng là
 Xem đáp án
Xem đáp án
Chọn B.
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag. Sau đó Fe(NO3)2 + AgNO3dư → Fe(NO3)3 + Ag
CaO + H2O → Ca(OH)2
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
Câu 26:
X, Y, Z, T là một trong số các dung dịch sau: glucozơ, fructozơ, glixerol, phenol. Thực hiện các thí nghiệm để nhận biết chúng và có kết quả như sau:
|
Chất |
X |
Y |
Z |
T |
|
Dung dịch AgNO3/NH3, đun nhẹ |
Xuất hiện kết tủa trắng bạc |
Xuất hiện kết tủa trắng bạc |
- |
- |
|
Nước Br2 |
- |
Nhạt màu |
- |
Xuất hiện kết tủa trắng |
|
Chất |
X |
Y |
Z |
T |
|
Dung dịch AgNO3/NH3, đun nhẹ |
Xuất hiện kết tủa trắng bạc |
Xuất hiện kết tủa trắng bạc |
- |
- |
|
Nước Br2 |
- |
Nhạt màu |
- |
Xuất hiện kết tủa trắng |
|
Chất |
X |
Y |
Z |
T |
|
Dung dịch AgNO3/NH3, đun nhẹ |
Xuất hiện kết tủa trắng bạc |
Xuất hiện kết tủa trắng bạc |
- |
- |
|
Nước Br2 |
- |
Nhạt màu |
- |
Xuất hiện kết tủa trắng |
Các dung dịch X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Chọn A.
Fructozo không có nhóm chức CHO, tuy nhiên trong môi trường bazo, fructozo và glucozo có sự chuyển hóa qua lại (glucozo có chứa CHO) → có phản ứng tráng bạc với AgNO3/NH3.
Glucozo có chứa CHO → vừa có phản ứng tráng bạc, vừa làm nhạt màu nước Br2.
Glixerol là ancol đa chức có công thức C3H5(OH)3 → không có các tính chất trên → không có hiện tượng.
Phenol: C6H5OH, tác dụng với nước brom: brom thế hidro trong vòng của phenol tại 3 vị trí 2, 4, 6 → tạo kết tủa trắng
Câu 27:
Tiến hành các thí nghiệm sau:
(a) Nhúng thanh Fe vào dung dịch CuSO4. (b) Dẫn khí CO qua Fe2O3 nung nóng.
(c) Điện phân dung dịch NaCl bão hòa, có màng ngăn.
(d) Đốt bột Fe trong khí oxi.
(e) Cho kim loại Ag vào dung dịch HNO3 loãng. (f) Nung nóng Cu(NO3)2.
(g) Cho Fe3O3 vào dung dịch H2SO4 đặc, nóng.
Số thí nghiệm có xảy ra sự oxi hóa kim loại là
 Xem đáp án
Xem đáp án
Chọn B
Xét từng thí nghiệm:
(a) Fe + CuSO4 → FeSO4 + Cu
(b) 3CO + Fe2O3 → Fe + 3CO2
(c) NaCl + H2O (đpdd) → NaOH + ½ H2 + ½ Cl2
(d) Fe + ½ O2 → FeO
(e) 3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
(f) Cu(NO3)2 → CuO + 2NO2 + O2
(g) 2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2 + 10H2O
Thí nghiệm xảy ra sự oxi hóa kim loại: (a) (d) (e).
Lưu ý: Xảy ra sự oxi hóa kim loại tức là kim loại đóng vai trò là chất khử.
Câu 28:
Tiến hành các thí nghiệm sau:
(a) Sục NH3 dư vào dung dịch AgNO3.
(b) Cho dung dịch Fe(NO3)3 vào dung dịch AgNO3.
(c) Cho hỗn hợp Ba và Al2O3 theo tỉ lệ mol 1:1 vào nước dư.
(d) Cho dung dịch NaAlO2 dư vào dung dịch HCl.
(e) Cho bột Cu và FeCl3 theo tỉ lệ mol 1 : 1 vào nước dư.
(f) Cho FeBr2 vào dung dịch K2Cr2O7 trong H2SO4 dư.
(g) Sục khí NH3 dư vào dung dịch NaCrO2.
(h) Cho hỗn hợp Fe(NO3)2 và Cu (tỉ lệ mol 1:3) vào dung dịch HCl loãng dư.
(i) Cho dung dịch Na2S dư vào dung dịch CaCl2.
(j) Cho 1 mol Al, 1 mol Zn vào dung dịch chứa 3 mol NaOH.
Sau khi kết thúc các phản ứng, số thí nghiệm sau khi kết thúc còn lại chất rắn không tan là:
 Xem đáp án
Xem đáp án
Chọn A
Các mệnh đề d, e.
+ TN a: tạo phức [Ag(NH3)2]OH.
+ TN b: Không có phản ứng.
+ TN c: Ba + 2H2O → Ba(OH)2 + H2. Sau đó: 2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2.
→ tỉ lệ 1:1 nên Ba(OH)2 dư
+ TN d: NaAlO2(dư) + HCl + H2O → Al(OH)3 + NaCl
+ TN e: Cu + 2FeCl3 → 2FeCl2 + CuCl2.
Tỉ lệ 1:1 → FeCl3 dư.
+ TN f: 2FeBr2 + K2Cr2O7 + 7H2SO4 → Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 2Br2 + 7H2O.
+ TN g: không tác dụng
+ TN h:
9Fe(NO3)2 + 12HCl → 3NO + 5Fe(NO3)3 + 4FeCl3 + 6H2O.
9------------------------------------------5------------4
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O.
22,5 ←15
2Fe3+ + Cu → 2Fe2+ + Cu2+.
9← 4,5
Tỉ lệ mol 1:3 → Cu hết, không tạo thêm chất rắn nào.
+ TN i: Na2S và CaCl2: không tác dụng.
+ TN j: 1 mol Al + 1 mol Zn tác dụng vừa đủ với 3 mol NaOH→ không tạo ra chất rắn, cũng không có rắn dư
Câu 29:
Thí nghiệm nào sau đây không xảy ra phản ứng?
 Xem đáp án
Xem đáp án
Chọn B.
Giải thích do kết tủa Ag3PO4 tan được trong HNO3 nên phản ứng trên không xảy ra
Câu 30:
Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí metylamin, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphtalein. Phát biểu nào sau đây đúng?

 Xem đáp án
Xem đáp án
Chọn A.
Nước trong chậu phun vào bình thành tia do khí tan nhiều trong nước làm giảm áp suất trong bình và nước bị hút vào bình
Câu 31:
Thực hiện thí nghiệm (như hình bên): Khi nhỏ dung dịch Y vào dung dịch X thấy có kết tủa tạo thành. Cặp dung dịch X, Y nào dưới đây thỏa mãn điều kiện trên ?

(1) dung dịch Br2, phenol. (2) dung dịch NaOH, phenol.
(3) dung dịch HCl, C6H5ONa. (4) dung dịch Br2, fomalin.
(5) dung dịch HCl, anilin. (6) dung dịch Br2, anilin.
 Xem đáp án
Xem đáp án
(1) tạo kết tủa 2,4,6-tribromphenol có màu trắng.
(2) ban đầu phenol ít tan trong nước nên trong dung dịch có vẩn đục, nhỏ NaOH sẽ phản ứng với phenol C6H5OH cho muối tan làm dung dịch trong suốt.
(3) ban đầu muối C6H5ONa là muối tan, sau khi nhỏ HCl vào sẽ tham gia phản ứng tạo C6H5OH vẩn đục trong dung dịch.
(4) HCHO + 2Br2 + H2O CO2 + 4HBr
(5) anilin cũng là hợp chất ít tan trong nước nên trong dung dịch sẽ có vẩn đục, sau khi nhỏ HCl vào sẽ có phản ứng: C6H5NH2 + HClC6H5NNH3Cl (dung dịch trong suốt).
(6) tạo kết tủa 2,4,6-tribromanilin có màu trắng.
=> Chọn đáp án B.
Câu 32:
Hòa tan hoàn toàn hai chất rắn X, Y (có số mol bằng nhau) vào nước thu được dung dịch Z. Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho dung dịch NaOH dư vào V ml dung dịch Z, thu được a mol kết tủa.
- Thí nghiệm 2: Cho dung dịch NH3 dư vào V ml dung dịch Z, thu được b mol kết tủa.
- Thí nghiệm 3: Cho dung dịch AgNƠ3 dư vào V ml dung dịch Z, thu được c mol kết tủa.
Biết các phản ứng xảy ra hoàn toàn và a < b < c. Hai chất X, Y không thể là
 Xem đáp án
Xem đáp án
Hai chất X, Y không thể là FeCl2, FeCl3 vì khi đó a = b.
=> Chọn đáp án C.
Câu 33:
Cho hình vẽ thí nghiệm dùng để phân tích hợp chất hữu cơ:

Cho hình vẽ thí nghiệm dùng để phân tích hợp chất hữu cơ:
 Xem đáp án
Xem đáp án
Nung nóng hợp chất hữu cơ với CuO, sục sản phẩm cháy qua dung dịch Ca(OH)2 để xác định nguyên tố C trong CO2 qua dấu hiệu thu được kết tủa:
![]() .
.
Bông trộn CuSO4 khan dùng để xác định nguyên tố H trong H2O vì nếu có hơi H2O trong sản phẩm cháy thì bông từ trắng chuyển sang màu xanh vì:
CuSO4 (trắng) + 5H2O → CuSO4.5H2O (xanh).
→ Chọn đáp án A.
Câu 34:
Tiến hành thí nghiệm với các chất X, Y, Z, T. Kết quả được ghi ở bảng sau:
|
Mẫu |
Thí nghiệm |
Hiện tượng |
|
X |
Tác dụng với Cu(OH)2 trong môi trường kiềm |
Có màu xanh lam |
|
|
Đun nóng với dung dịch H2SO4 loãng. Thêm tiếp dung dịch AgNO3 trong NH3 đun nóng |
Tạo kết tủa Ag |
|
Y |
Đun nóng với dung dịch NaOH (loãng, dư), để nguội. Thêm tiếp vài giọt dnug dịch CuSO4 |
Tạo dung dịch màu xanh lam |
|
Z |
Tác dụng với quỳ tím |
Quỳ tím chuyển màu xanh |
|
T |
Tác dụng với nước Brom |
Có kết tủa trắng |
Các chất X, Y, Z, T lần lượt là:
 Xem đáp án
Xem đáp án
X tác dụng với Cu(OH)2 trong môi trường kiềm cho dung dịch xanh lam
→ X không thể là xenlulozơ và hồ tinh bột → Loại A, B.
Y Đun nóng với dung dịch NaOH (loãng, dư), để nguội. Thêm tiếp vài giọt dung dịch CuSO4 cho dung dịch màu xanh lam chứng tỏ Y bị thủy phân trong NaOH cho poliol → Y không thể là etyl axetat → Loại C.
→ Đáp án thỏa mãn là saccarozơ, triolein, lysin, anilin.
→ Chọn đáp án D.
Câu 35:
Tiến hành các thí nghiệm sau:
(a) Cho Ca(HCO3)2 vào dung dịch Ca(OH)2.
(b) Cho Zn vào dung dịch FeCl3 (dư).
(c) Cho dung dịch Ba(OH)2 (dư) vào dung dịch Al2(SO4)3.
(d) Cho khí CO2 (dư) vào dung dịch hỗn hợp gồm Ba(OH)2 và NaOH.
(e) Cho dung dịch HCl (dư) vào dung dịch NaAlO2.
(f) Cho dung dịch NaOH vào dung dịch MgCl2.
Số thí nghiệm có tạo ra kết tủa là:
 Xem đáp án
Xem đáp án
Xét từng thí nghiệm:
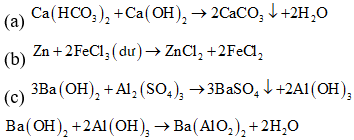
![]()
![]()
![]()
![]()

