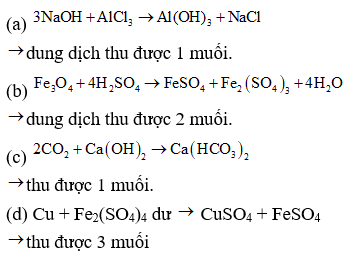230 Bài tập thí nghiệm Hóa Học cực hay có đáp án(Đề số 6)
-
3073 lượt thi
-
30 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Tiến hành các thí nghiệm sau:
(a) Thả một viên Fe vào dung dịch HCl.
(b) Thả một viên Fe vào dung dịch Cu(NO3)2.
(c) Thả một viên Fe vào dung dịch FeCl3.
(d) Nối một dây Ni với một dây Fe rồi để trong không khí ẩm.
(e) Đốt một dây Fe trong bình kín chứa đầy khí O2.
(f) Thả một viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng.
Số thí nghiệm mà Fe không bị ăn mòn điện hóa học là
 Xem đáp án
Xem đáp án
Chọn C
Câu 2:
Kết quả thí nghiệm của các chất X, Y, Z với các thuốc thử được ghi ở bảng sau:
|
Chất |
Thuốc thử |
Hiện tượng |
|
X |
Cu(OH)2 |
Tạo hợp chất màu tím |
|
Y |
Dung dịch AgNO3 trong NH3 |
Tạo kết tủa Ag |
|
Z |
Nước brom |
Tạo kết tủa trắng |
Các chất X, Y, Z lần lượt là
 Xem đáp án
Xem đáp án
Chọn A
Câu 3:
Bộ dụng cụ chiết được mô tả như hình vẽ sau đây:
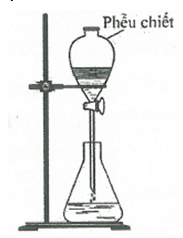
Thí nghiệm trên được dùng để tách hai chất lỏng nào sau đây?
 Xem đáp án
Xem đáp án
Chọn A
Câu 4:
Trong các thí nghiệm sau:
(1) Cho khí NH3 tác dụng với CuO đun nóng.
(2) Cho Si đơn chất tác dụng với dung dịch NaOH.
(3) Cho CrO3 tác dụng với NH3.
(4) Cho dung dịch NH4Cl tác dụng với dung dịch NaNO2 đun nóng.
Số thí nghiệm tạo ra đơn chất là
 Xem đáp án
Xem đáp án
Chọn C
Câu 6:
Cho các thí nghiệm sau:
(1) Thanh Fe nhúng vào dung dịch H2SO4 loãng.
(2) Thanh Fe có quấn dây Cu nhúng vào dung dịch H2SO4 loãng.
(3) Thanh Cu mạ Ag nhúng vào dung dịch HCl.
(4) Thanh Fe tráng thiếc bị xước sâu vào tới Fe nhúng vào dung dịch H2SO4 loãng.
(5) Miếng gang để trong không khí ẩm.
Hãy cho biết có bao nhiêu quá trình xảy ra theo cơ chế ăn mòn điện hóa?
 Xem đáp án
Xem đáp án
Chọn C
Câu 7:
Trong các thí nghiệm sau:
(1) Mg phản ứng với dung dịch HNO3 loãng.
(2) Fe tác dụng với dung dịch H2SO4 đặc nóng.
(3) Cho từ từ đến dư dung dịch HCl vào dung dịch Na2CO3.
(4) K tác dụng với dung dịch CuSO4.
(5) CO2 tác dụng với dung dịch Ca(OH)2 dư.
(6) Dung dịch NaHCO3 tác dụng với dung dịch H2SO4 loãng.
(7) FeO tác dụng với dung dịch HNO3 loãng.
Số thí nghiệm chắc chắn có khí thoát ra là
 Xem đáp án
Xem đáp án
Chọn B
Câu 8:
Tiến hành thí nghiệm với các chất X, Y, Z, T (trong dung dịch) thu được các kết quả như sau:
|
Mẫu thử |
Thí nghiệm |
Hiện tượng |
|
X hoặc T |
Tác dụng với quỳ tím |
Quỳ tím chuyển màu xanh |
|
Y |
Tác dụng với dung dịch AgNO3/NH3 đun nóng |
Có kết tủa Ag |
|
Z |
Tác dụng với dung dịch AgNO3/NH3 |
Không hiện tượng |
|
Y hoặc Z |
Tác dụng với Cu(OH)2 trong môi trường kiềm |
Dung dịch xanh lam |
|
T |
Tác dụng với Cu(OH)2 trong môi trường kiềm |
Có màu tím |
|
Mẫu thử |
Thí nghiệm |
Hiện tượng |
|
X hoặc T |
Tác dụng với quỳ tím |
Quỳ tím chuyển màu xanh |
|
Y |
Tác dụng với dung dịch AgNO3/NH3 đun nóng |
Có kết tủa Ag |
|
Z |
Tác dụng với dung dịch AgNO3/NH3 |
Không hiện tượng |
|
Y hoặc Z |
Tác dụng với Cu(OH)2 trong môi trường kiềm |
Dung dịch xanh lam |
|
T |
Tác dụng với Cu(OH)2 trong môi trường kiềm |
Có màu tím |
|
Mẫu thử |
Thí nghiệm |
Hiện tượng |
|
X hoặc T |
Tác dụng với quỳ tím |
Quỳ tím chuyển màu xanh |
|
Y |
Tác dụng với dung dịch AgNO3/NH3 đun nóng |
Có kết tủa Ag |
|
Z |
Tác dụng với dung dịch AgNO3/NH3 |
Không hiện tượng |
|
Y hoặc Z |
Tác dụng với Cu(OH)2 trong môi trường kiềm |
Dung dịch xanh lam |
|
T |
Tác dụng với Cu(OH)2 trong môi trường kiềm |
Có màu tím |
Biết T là chất hữu cơ mạch hở. Các chất X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Chọn B
Câu 9:
Tiến hành các thí nghiệm sau:
(1) Cho lá sắt vào dung dịch HCl có thêm vài giọt CuSO4.
(2) Cho lá sắt vào dung dịch FeCl3.
(3) Cho lá thép vào dung dịch ZnSO4.
(4) Cho lá sắt vào dung dịch CuSO4.
(5) Cho lá kẽm vào dung dịch HCl.
Số trường hợp xảy ra sự ăn mòn điện hóa là
 Xem đáp án
Xem đáp án
Chọn C
Câu 10:
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư. (b) Sục khí Cl2 vào dung dịch FeCl2.
(c) Dần khí H2 dư qua bột CuO nung nóng. (d) Cho Na vào dung dịch CuSO4 dư.
(e) Nhiệt phân AgNO3. (g) Đốt Fe2S trong không khí.
(h) Điện phân dung dịch CuSO4 với điện cực trơ.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
 Xem đáp án
Xem đáp án
Chọn A
Câu 11:
Thí nghiệm được tiến hành như hình vẽ bên:
Hiện tượng xảy ra trong bình đựng dung dịch AgNO3 trong NH3 là
 Xem đáp án
Xem đáp án
Chọn B
Câu 12:
Tiến hành các thí nghiệm sau:
(1) Cho dung dịch Al(NO3)3 vào dung dịch FeSO4 và H2SO4.
(2) Sục khí H2S vào dung dịch FeCl2
(3) Cho Cu vào dung dịch Fe(NO3)3
(4) Cho nước Br2 vào dung dịch Fe2(SO4)3.
(5) Cho dung dịch KMnO4 vào dung dịch chứa FeSO4 và H2SO4.
(6) Cho dung dịch AgNO3 vào dung dịch chứa Fe(NO3)2.
(7) Cho Fe vào dung dịch H2SO4 đặc, nguội.
(8) Cho CrO3 vào dung dịch chứa FeSO4 và H2SO4.
Số thí nghiệm xảy ra phản ứng là
 Xem đáp án
Xem đáp án
Chọn D
Câu 13:
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Dung dịch AgNO3 trong NH3 |
Kết tủa Ag |
|
Y |
Quỳ tím |
Chuyển màu xanh |
|
Z |
Cu(OH)2 |
Màu xanh lam |
|
T |
Nước brom |
Kết tủa trắng |
Các chất X, Y, Z, T lần lượt là:
 Xem đáp án
Xem đáp án
Chọn D
Câu 14:
Thực hiện thí nghiệm như hình vẽ bên.

Hiện tượng xảy ra trong bình chứa dung dịch Br2 là
 Xem đáp án
Xem đáp án
Chọn A
Câu 16:
Thực hiện các thí nghiệm sau:
(1) Cho dung dịch AgNO3 vào dung dịch HCl.
(2) Cho bột nhôm vào bình kín khí clo.
(3) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
(4) Nhỏ ancol etylic vào CrO3.
(5) Sục khí SO4 vào dung dịch thuốc tím.
(6) Ngâm Si trong dung dịch NaOH.
Số thí nghiệm xảy ra phản ứng ở điều kiện thường là
 Xem đáp án
Xem đáp án
Chọn A
Câu 17:
Tiến hành các thí nghiệm sau:
(a) Cho dung dịch AgNO3 vào dung dịch HCl.
(b) Cho Al2O3 vào dung dịch NaOH loãng dư.
(c) Cho Cu vào dung dịch H2SO4 đặc, nóng dư.
(d) Cho Ba(OH) 2 vào dung dịch NaHCO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
Chọn D
Câu 18:
Tiến hành các thí nghiệm với X, Y, Z, T được kết quả theo bảng sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Dung dịch brom |
Tạo kết tủa trắng |
|
Y |
Dung dịch AgNO3 trong NH3 đun nóng |
Tạo kết tủa vàng |
|
Z |
Cu(OH)2 |
Tạo dung dịch màu xanh lam |
|
T |
Quỳ tím |
Hóa đỏ |
X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Chọn A
Câu 19:
Cho các thí nghiệm sau:
(1) Nhiệt phân Fe(NO3)2. (2) Cho Mg dư tác dụng với dung dịch FeCl3.
(3) Cho khí NH3 tác dụng với CuO đun nóng. (4) Đốt cháy HgS bằng O2.
Số thí nghiệm tạo ra đơn chất là
 Xem đáp án
Xem đáp án
Chọn B
Câu 20:
Kết tinh là một trong những phương pháp phổ biến để tách biệt và tinh chế hợp chất hữu cơ. Hình bên mô tả các bước tiến hành kết tinh:
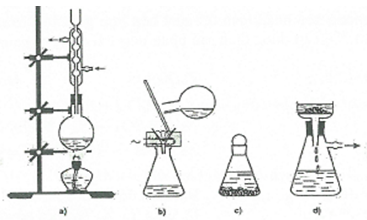
a) Hoà tan bão hoà hỗn hợp chất rắn ở nhiệt độ sôi của dung môi
b) Lọc nóng loại bỏ chất không tan.
c) Để nguội cho kết tinh.
d) Lọc hút để thu tinh thể.
Trình tự các bước tiến hành kết tinh đúng là
 Xem đáp án
Xem đáp án
Phân tích và hướng dẫn giải
Các bước tiến hành kết tinh
+ Hòa tan bão hòa hỗn hợp chất rắn ở nhiệt độ sôi của dung môi
+ Lọc nóng loại bỏ các chất không tan, tạp chất
+ Để nguội cho kết tinh (chú ý, trong quá trình này, để nguyên cho chất tự kết tinh, không có tác động vào chất thì tinh thể tạo thành mới to, mịn hơn)
+ Lọc hút để thu được tinh thể
![]() Chọn đáp án A.
Chọn đáp án A.
Câu 21:
Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 vào dung dịch Ca(OH)2 dư (2) Sục khí NH3 dư vào dung dịch AlCl3
(3) Sục khí CO2 dư vào dung dịch NaAlO2 (4) Cho dung dịch AgNO3 vào dung dịch FeCl3
(5) Cho dung dịch HCl vào dung dịch K2SiO3 (6) Cho ure vào dung dịch Ca(OH)2
Sau khi kết thúc thí nghiệm, số trường hợp thu được kết tủa là
 Xem đáp án
Xem đáp án
Phân tích và hướng dẫn giải
Xét từng thí nghiệm:
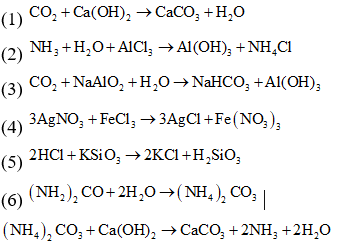
Cả 6 thí nghiệm đều thu được kết tủa.
![]() Chọn đáp án C.
Chọn đáp án C.
Câu 22:
Kết quả thí nghiệm của các chất X, Y, Z, T với một số thuốc thử được ghi ở bảng sau:
|
Chất |
X |
Y |
Z |
T |
|
Dung dịch nước brom |
|
Dung dịch mất rnàu |
Kết tủa trắng |
Dung dịch mất màu |
|
Kim loại Na |
Có khí thoát ra |
|
Có khí thoát ra |
Có khí thoát ra |
Các chất X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Phân tích và hướng dẫn giải
+) Vì Y làm mất màu nước brom nên loại Y là benzen => loại đáp án C.
+) Z có tạo kết tủa với nước brom nên loại đáp án Z là axit axetic và stiren
=> loại đáp án B, D.
![]() Chọn đáp án A.
Chọn đáp án A.
Câu 23:
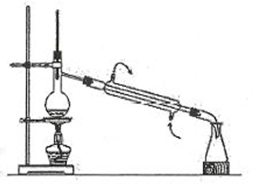
Cho bộ dụng cụ chưng cất thường như hình vẽ:
Phương pháp chưng cất dùng để
 Xem đáp án
Xem đáp án
Chọn A
Câu 24:
Tiến hành các thí nghiệm sau:
1: TN 1: Cho hơi nước đi qua ống đựng bột sắt nung nóng.
2: TN 2: Cho đinh sắt nguyên chất vào dung dịch H2SO4 loãng có nhỏ thêm vài giọt dung dịch CuSO4.
3: TN 3: Cho từng giọt dung dịch Fe(NO3)2 vào dung dịch AgNO3
4: TN 4: Để miếng gang (hợp kim của sắt với cacbon) trong không khí ẩm một thời gian.
5: TN 5: Nhúng lá kẽm nguyên chất vào dung dịch CuSO4.
Số trường hợp xảy ra ăn mòn điện hoá học là:
 Xem đáp án
Xem đáp án
Chọn A
Câu 25:
Tiến hành các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường.
(b) Hấp thụ hết 2 mol CO2 vào dung dịch chứa 3 mol NaOH.
(c) Cho KMnO4 vào dung dịch HCl đặc dư.
(d) Cho hỗn hợp Fe3O4 vào dung dịch HCl dư.
(e) Cho CuO vào dung dịch HNO3.
(f) Cho KHS vào dung dịch NaOH vừa đủ.
Số thí nghiệm thu được hai muối l
 Xem đáp án
Xem đáp án
Chọn C
Câu 26:
Tiến hành thí nghiệm với các chất X, Y, Z, T. Kết quả được ghi ở bảng sau:
|
Mẫu thử |
Thí nghiệm |
Hiện tượng |
|
X |
Tác dụng với Cu(OH)2 |
Hợp chất có màu tím |
|
Y |
Quỳ tím ẩm |
Quỳ đổi màu xanh |
|
Z |
Tác dụng với dung dịch Br2 |
Dung dịch mất màu và tạo kết tủa trắng |
|
T |
Tác dụng với dung dịch Br2 |
Dung dịch mất màu |
Các chất X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Chọn D
Câu 27:
Trong phòng thí nghiệm, khí c được điều chế bằng bộ dụng cụ như hình sau:
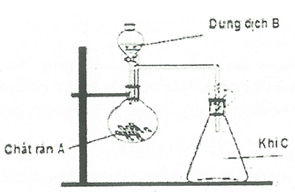
Khí C có thể là dãy các khí nào sau đây?
 Xem đáp án
Xem đáp án
+) Khí C được điều chế bằng cách cho dung dịch B tác dụng với chất rắn A ở nhiệt độ thường.
+) Khí C được thu bằng cách đẩy không khí và ngửa bình nên C không phản ứng với O2 ở nhiệt độ thường và nặng hơn không khí.
Các khí thỏa mãn:
NO2: (A: Cu; B: HNO3)
Cl2 (A: KMnO4; B: HCl đặc)
CO2 (A: CaCO3; B: HCl loãng)
SO2 (A: Cu; B: H2SO4 đặc).
Dãy các chất thỏa mãn: NO2, Cl2, CO2, SO2.
Loại các đáp án khác vì:
+) H2 nhẹ hơn không khí,
+) N2 nhẹ hơn không khí, điều chế bằng cách nhiệt phân NH4NO2.
+) N2O được điều chế bằng cách nhiệt phân NH4NO3
=> Chọn đáp án B.
Câu 28:
Trong thí nghiệm nào sau đây xảy ra ăn mòn điện hóa
 Xem đáp án
Xem đáp án
Điều kiện ăn mòn điện hóa:
+) Các điện cực phải khác chất nhau
+) Các điện cực phải tiếp xúc với nhau
+) Các điện cực cùng tiếp xúc với một dung dịch điện li
Xét từng đáp án
A. Xuất hiện 2 điện cực là Fe và Cu![]() là ăn mòn điện hóa.
là ăn mòn điện hóa.
B. Không phải là ăn mòn điện hóa vì không có dung dịch chất điện li.
C. Đây là ăn mòn hóa học.
D. Không có cặp điện cực nên không phải là ăn mòn điện hóa.
=>Chọn đáp án A.
Câu 29:
Cho các chất: AgNO3, Cu(NO3)2, MgCO3, CaCO3, Ba(HCO3)2, NH4HCO3, NH4NO3 và Fe(NO3)2. Nếu nung các chất trên đến khối lượng không đổi trong các bình kín không có không khí, rồi cho nước vào các bình, số bình có thể tạo lại chất ban đầu sau các thí nghiệm là
 Xem đáp án
Xem đáp án
Các chất thỏa yêu cầu đề bài là AgNO3, Cu(NO3)2, CaCO3, Ba(HCO3)2, NH4HCO3.
=> Chọn đáp án C.