230 Bài tập thí nghiệm Hóa Học cực hay có đáp án(Đề số 7)
-
3075 lượt thi
-
32 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Tiến hành thi nghiệm với các chất X, Y, z, T. Kết quả được ghi ở bảng sau:
|
Mẫu thử |
Thí nghiệm |
Hiện tượng |
|
X |
Tác dụng với Cu(OH)2 |
Hợp chất có màu tím |
|
Y |
Quỳ tím ẩm |
Quỳ đổi màu xanh |
|
Z |
Tác dụng với dung dịch Br2 |
Dung dịch mất màu và tạo kết tủa trắng |
|
T |
Tác dụng với dung dịch Br2 |
Dung dịch mất màu |
Các chất X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Để ý rằng Z phản ứng Br2 tạo kết tủa trắng, trong các đáp án chỉ có anilin
=> Chọn đáp án D.
Câu 2:
Cho X, Y, Z, M là các kim loại. Thực hiện các thí nghiệm sau:
|
Thí nghiệm 1 |
M + dung dịch muối X |
|
Thí nghiệm 2 |
X + dung dịch muối Y |
|
Thí nghiệm 3 |
X + dung dịch muối Z: không xảy ra phản ứng |
|
Thí nghiệm 4 |
Z + dung dịch muối M: không xảy ra phản ứng |
Chiều tăng dần tính khử của các kim loại X, Y, Z, M là
 Xem đáp án
Xem đáp án
Xét từng thí nghiệm:
- Từ thí nghiệm 1, có khí thoát ra, chứng tỏ kim loại đó có tác dụng với H2OM là kim loại kiềm hoặc kiềm thổ.
- Từ thí nghiệm 2 tính khử của Y < X nên X đẩy được Y ra khỏi muối của nó.
- Từ thí nghiệm 3 tính khử của X < Z
- Từ thí nghiệm 4 tính khử của Z < M
Vậy thứ tự tính khử của các kim loại theo thứ tự tăng dần: Y < X < Z < M.
Chọn đáp án D.
Câu 3:
Tiến hành phản ứng khử oxit X thành kim loại bằng khí CO (dư) theo sơ đồ hình vẽ:
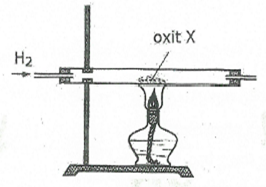
Oxit X là
 Xem đáp án
Xem đáp án
Oxit X phải là oxit của kim loại đứng sau Al trong dãy điện hoá
=>Chọn đáp án C.
Câu 4:
Tiến hành thí nghiệm cho nitrobenzen tác dựng với HNO3 (đ)/H2SO4 (đ), nóng ta thấy:
 Xem đáp án
Xem đáp án
Nitrobenzen có chứa nhóm thế NO2 là nhóm hút e
=> Làm mật độ e trên vòng giảm.
=> Khả năng tham gia phản ứng thế khó khăn và ưu tiên vào vị trí meta.
=> Chọn đáp án C.
Câu 5:
Thực hiện các thí nghiệm sau:
(1) Cho Na vào dung dịch FeCl3. (2) Cho Zn vào dung dịch FeCl2.
(3) Cho Mg vào dung dịch FeCl3 dư. (4) Cho Cu vào dung dịch FeCl3.
Số thí nghiệm thu được Fe sau phản ứng là
 Xem đáp án
Xem đáp án
Các phản ứng:
![]()
![]()
![]()
(3) Mg + 2FeCl3 dư MgCl2 + 2FeCl2.
(4) Cu + 2FeCl3 CuCl2 + 2FeCl2.
=> Chọn đáp án B.
Câu 6:
Cho các thí nghiệm sau:
(a) Cho CaCO3 vào dung dịch CH3COOH dư.
(b) Cho hỗn hợp Na2O và Al2O3 (tỉ lệ tương ứng 1:1) vào H2O dư.
(c) Cho Ag vào dung dịch HCl dư.
(d) Cho Na vào dung dịch CuSO4 dư.
(e) Cho Ba(HCO3)2 vào dung dịch NaHSO4 dư.
Số thí nghiệm có sự hòa tan chất rắn chỉ tạo ra dung dịch trong suốt là
 Xem đáp án
Xem đáp án
Xét lần lượt từng thí nghiệm:
(a) (CH3COO)2Ca + CH3COOH (thỏa)
(b) Na(AlO2) (thỏa)
(c) không pư
(d) có tạo kết tủa Cu(OH)2
(e) có tạo kết tủa BaSO4
Chọn đáp án D.
Câu 7:
Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: CH3NH2, NH3, C6H5OH (phenol), C6H5NH2 (anilin) và các tính chất được ghi trong bảng sau:
Nhận xét nào sau đây không đúng?
|
Chất |
X |
Y |
Z |
T |
|
Nhiệt độ sôi (°C) |
182 |
184 |
-6,7 |
-33,4 |
|
pH (dung dịch nồng độ 0,001M) |
6,48 |
7,82 |
10,81 |
10,12 |
 Xem đáp án
Xem đáp án
Z và T có nhiệt độ sôi thấp nhất 2 khí
CH3NH2 và NH2 mà xét độ pH của Z > T
Tính bazơ của Z > T Z là CH3NH2 và T là NH3.
xét độ pH của X và Y thấy X có tính axit còn Y có tính bazơ X là phenol còn Y là anilin.
Xét từng phát biểu:
+ CH3NH2 và NH3 có tính bazơ làm quỳ ẩm chuyển xanh.
+ Dung dịch phenol có tính axit và dung dịch anilin, CH3NH2, NH3 có tính bazơ.
+ X tác dụng với nước brom cho 2,4,6-tribromphenol (kết tủa trắng); Y tác dụng nước brom cho 2,4,6-tribromanilin (kết tủa hắng).
+ Dung dịch phenol có tính axit và dung dịch anilin có tính bazơ tuy nhiên tính axit, bazơ quá yếu không đổi màu quỳ tím nên không phân biệt được.
Chọn đáp án D.
Câu 8:
Tiến hành các thí nghiệm sau:
(a) Sục khí H2S vào dung dịch FeSO4.
(b) Sục khí H2S vào dung dịch CuSO4.
(c) Sục khí CO2 đến dư vào dung dịch Na2SiO3.
(d) Sục khí CO2 đến dư vào dung dịch Ca(OH)2.
(e) Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch Al2(SO4)3.
(f) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
Số thí nghiệm thu được kết tủa là: (b), (c), (e), (f).
(a) Vì FeS sinh ra tan trong H2SO4.
![]()
Câu 9:
Thực hiện các thí nghiệm sau:
(1) Cho dung dịch NaOH dư vào dung dịch Ca(HCO3)2.
(2) Cho Ca vào dung dịch Ba(HCO3)2.
(3) Cho Ba vào dung dịch H2SO4 loãng.
(4) Cho H2S vào dung dịch Fe2(SO4)3.
(5) Cho SO2 đến dư vào dung dịch H2S.
(6) Cho NaHCO3 vào dung dịch BaCl2.
(7) Cho dung dịch NaAlO2 dư vào dung dịch HCl.
Số trường hợp xuất hiện kết tủa khi kết thúc thí nghiệm là
 Xem đáp án
Xem đáp án
Các phản ứng:
![]()
Câu 10:
Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 dư vào dung dịch Ca(OH)2.
(2) Sục khí NH3 dư vào dung dịch AlCl3.
(3) Sục khi CO2 dư vào dung dịch NaAlO2.
(4) Cho dung dịch AgNO3 vào dung dịch FeCl3.
(5) Cho dung dịch HCl vào dung dịch K2SiO3.
(6) Cho ure vào dung dịch Ca(OH)2.
Sau khi kết thúc thí nghiệm, số trường hợp thu được kết tủa là
 Xem đáp án
Xem đáp án
Xét từng thí nghiệm:
(1) không có kết tủa do CO2 dư hòa tan kết tủa CaCO3 tạo thành trước đó.
(2) tạo kết tủa Al(OH)3.
(3) tạo kết tủa Al(OH)3.
(4) tạo kết tủa AgCl.
(5) tạo kết tủa H2SiO3.
(6) tạo kết tủa CaCO3.
=> Chọn đáp án D.
Câu 11:
Tiến hành thí nghiệm với các chất sau: glucozơ, anilin, fructozơ và phenol (C6H5OH). Kết quả được ghi ở bảng sau:
Các chất X, Y, Z, T trong bảng lần lượt là các chất:
|
Thuốc thử |
X |
T |
Z |
Y |
(+): phản ứng (-): không phản ứng |
|
Nước Br2 |
Kết tủa |
Nhạt màu |
Kết tủa |
(-) |
|
|
Dung dịch AgNO3 trong NH3, đun nóng |
(-) |
Kết tủa |
(-) |
Kết tủa |
|
|
Dung dịch NaOH |
(-) |
(-) |
(+) |
(-) |
 Xem đáp án
Xem đáp án
Xét chất Y thấy anilin và phenol không tham gia phản ứng với dung dịch AgNO3 trong NH3, đun nóng ![]() loại A, D.
loại A, D.
Xét chất Z thấy anilin không tham gia phản ứng với NaOH ![]() loại C.
loại C.
Chọn đáp án B.
Câu 12:
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3) như các hình vẽ dưới đây:


Có thể dùng cách nào trong 3 cách trên để thu khí O2 ?
 Xem đáp án
Xem đáp án
Khí O2 nặng hơn không khí không thu bằng phương pháp 1 vì O2 sẽ ở phía dưới và không khí phía trên Khí bị thoát ra ngoài.
O2 rất ít tan trong nước nên có thể thu bằng phương pháp đẩy nước.
Chọn đáp án D.
Câu 13:
Thí nghiệm nào sau đây không xảy ra phản ứng hóa học ?
 Xem đáp án
Xem đáp án
Ag là kim loại đứng sau H không phản ứng với dung dịch HCl.
Chọn đáp án D.
Câu 14:
Tiến hành các thí nghiệm sau:
(a) Cho dung dịch chứa 4a mol NaOH vào dung dịch chứa a mol AlCl3.
(b) Cho Al(OH)3 vào lượng dư dung dịch NaOH.
(c) Sục khí CO2 đến dư vào dung dịch Ca(OH)2.
(d) Cho Cu vào dung dịch Fe2(SO4)3 dư.
(e) Cho dung dịch chứa a mol KHSO4 vào dung dịch chứa a mol NaHCO3.
(g) Cho Al dư vào dung dịch HNO3 (phản ứng không thu được chất khí)
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được dung dịch chứa hai muối là
 Xem đáp án
Xem đáp án
Các thí nghiệm thu được dung dịch chứa hai muối là (a), (e), (g).
4NaOH + AlCl3 NaAlO2 + 3NaCl + 2H2O
Al(OH)3 (dư) + NaOH NaAlO2 + 2H2O
CO2 (dư) + Ca(OH)2 Ca(HCO3)2
Cu + Fe2(SO4)3 (dư) CuSO4 + 2FeSO4 (Chú ý có muối dư)
2KHSO4 + 2NaHCO3 K2SO4 + Na2SO4 + CO2 + 2H2O
8Al + 30HNO3 8Al(NO3)3 + 3NH4NO3 + 9H2O
Chọn đáp án B.
Câu 15:
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch HCl vào dung dịch Fe(NO3) 2.
(b) Cho FeS vào dung dịch HCl.
(c) Cho Cr2O3 vào dung dịch NaOH loãng.
(d) Cho dung dịch AgNO3 vào dung dịch FeCl3.
(e) Cho Fe vào bình chứa HCl đặc, nguội.
(f) Sục khí SO2 vào dung dịch KMnO4.
(g) Al2O3 vào dung dịch KOH.
(h) KMnO4 vào dung dịch hỗn hợp FeSO4 và H2SO4.
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng là
 Xem đáp án
Xem đáp án
Các thí nghiệm xảy ra phản ứng là a, b, d, e, f, g, h.
Cr2O3 chỉ tan trong NaOH đặc nóng, có điều kiện áp suất cao.
![]()

![]()
![]()
=> Chọn đáp án C.
Câu 16:
Tiến hành các thí nghiệm sau:
(a) Cho lá hợp kim Fe-Cu vào dung dịch H2SO4 loãng.
(b) Cho lá Cu vào dung dịch AgNO3.
(c) Cho lá Zn vào dung dịch HNO3 loãng.
(d) Đốt dây Mg trong bình đựng khí clo.
Số thí nghiệm có xảy ra ăn mòn hóa học là
 Xem đáp án
Xem đáp án
Có phản ứng xảy ra là có ăn mòn hóa học, vậy tất cả các thí nghiệm trên đều phản ứng nên có xảy ra ăn mòn hóa học.
Chọn đáp án C.
Câu 17:
Trong phòng thí nghiệm, isoamyl axetat (dầu chuối) được điều chế từ phản ứng giữa axit cacboxylic và ancol tương ứng. Nguyên liệu điều chế isoamyl axetat là:
 Xem đáp án
Xem đáp án
Phương trình điều chế isoamyl axetat:
![]()
![]()
=> Chọn đáp án B.
Câu 18:
Tiến hành các thí nghiệm sau:
(1) Cho dung dịch Al(NO3)3 vào dung dịch chứa FeSO4 và H2SO4.
(2) Sục khí H2S vào dung dịch FeCl2.
(3) Cho Cu vào dung dịch Fe(NO3)3.
(4) Cho nước Br2 vào dung dịch Fe2(SO4)3.
(5) Cho dung dịch KMnO4 vào dung dịch chứa FeSO4 và H2SO4.
(6) Cho dung dịch AgNO3 vào dung dịch chứa Fe(NO3)2.
(7) Cho Fe vào dung dịch H2SO4 đặc nguội.
(8) Cho CrO3 vào dung dịch chứa FeSO4 và H2SO4.
Số thí nghiệm xảy ra phản ứng là
 Xem đáp án
Xem đáp án
Xét từng thí nghiệm:
![]()
(2) Không xảy ra phản ứng vì FeS tan trong HCl
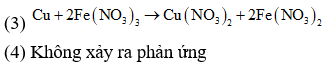
![]()
![]()
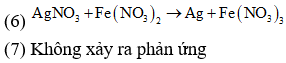
![]()
![]()
Số thí nghiệm xảy ra phản ứng: 5.
=> Chọn đáp án B.
Câu 19:
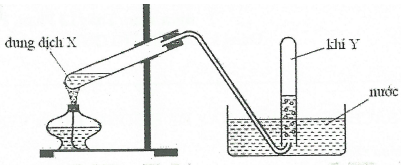
Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ dung dịch X:
Hình vẽ trên minh họa phản ứng nằo sau đây ?
 Xem đáp án
Xem đáp án
Loại A và C vì NH3 và HCl tan tốt trong nước.
Loại D vì CH3COONa là chất rắn, không phải "dung dịch".
=> Chọn đáp án B.
Câu 21:
Thực hiện các thí nghiệm với hỗn hợp gồm X gồm Ag và Cu. Thí nghiệm mà Cu bị oxi hóa còn Ag không bị oxi hóa là
 Xem đáp án
Xem đáp án
Cho X vào O3: Cu + O3 CuO + O2 và 2Ag + O3 Ag2O + O2.
Cho X vào HNO3 đặc: Cu + 4HNO3 Cu(NO3)2 + 2NO2 + 2H2O
và Ag + 2HNO3 AgNO3 + NO2 + H2O
Cho X vào HCl: cả 2 kim loại không phản ứng.
Cho X vào lượng dư dung dịch FeCl3: Cu + 2FeCl3 2FeCl2 + CuCl2.
=> Chọn đáp án D.
Câu 22:
Thực hiện các thí nghiệm sau:
(1) Nung NaHCO3 rắn.
(2) Cho CaOCl2 vào dung dịch HCl đặc.
(3) Sục khí CO2 vào dung dịch Ba(OH)2 dư.
(4) Sục khí SO2 vào dung dịch KMnO4.
(5) Cho dung dịch KHSO4 vào dung dịch NaHCO3.
(6) Sục khí Cl2 vào dung dịch KI.
Số thí nghiệm sinh ra chất khí là:
 Xem đáp án
Xem đáp án
Xét lần lượt từng thí nghiệm:
(1) Sinh ra khí CO2: ![]() .
.
(2) Sinh ra khí Cl2: CaOCl2 + 2HCl đặc CaCl2 + Cl2![]() + H2O.
+ H2O.
(5) Sinh ra khí CO2: 2KHSO4 + 2NaHCO3 K2SO4 + Na2SO4 + 2CO2 + 2H2O.
=> Chọn đáp án D.
Câu 23:
Hình vẽ sau đây mô tả thí nghiệm điều chế chất hữu cơ Y:
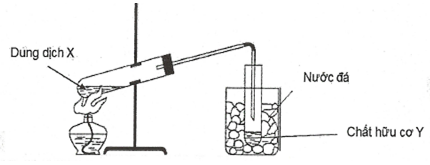
Phản ứng nào sau đây xảy ra trong thí nghiệm trên?
 Xem đáp án
Xem đáp án
+) Cu(OH)2 là chất rắn Loại A.
+) Các muối của Na không bay hơi nên không cần ngưng tụ Loại C, D.
Chỉ có thí nghiệm điều chế este là thỏa mãn:
CH3COOH + C2H5OH CH3COOC2H5 + H2O
CHỌN B
Câu 24:
Có 4 đung dịch bị mất nhãn được đánh thứ tự X, Y, Z, T. Mỗi dung dịch trên chỉ chứa 1 trong số các chất tan sau đây: HCl, H2SO4, Na2CO3, NaOH, NaHCO3, BaCl2. Để xác định chất tan trong mỗi dung dịch người ta tiến hành các thí nghiệm và thu được kết quả như sau:
|
|
Dung dịch X |
Dung dịch Y |
Dung dịch Z |
Dung dịch T |
|
Dung dịch HCl |
Có khí thoát ra |
Có khí thoát ra |
Không hiện tượng |
Không hiện tượng |
|
Dung dịch BaC2 |
Không hiện tượng |
Có kết tủa trắng |
Không hiện tượng |
Không hiện tượng |
|
Dung dịch Na2CO3 |
Không hiện tượng |
Không hiện tượng |
Có khí thoát ra |
Có kết tủa trắng |
Nhận xét nào sau đây đúng ?
 Xem đáp án
Xem đáp án
X: NaHCO3; Y: Na2CO3; Z: HCl; T: BaCl2
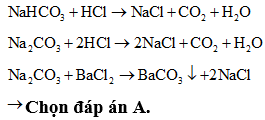
Câu 25:
Cho hình vẽ thiết bị chưng cất thường:

Vai trò của nhiệt kế trong khi chưng cất là
 Xem đáp án
Xem đáp án
Phương pháp chưng cất dùng để tách các chất lỏng có nhiệt độ sôi khác nhau. Chất có nhiệt độ sôi thấp hơn sẽ chuyển thành hơi sớm hơn. Ta dùng nhiệt kế đo nhiệt độ sôi của chất đang chưng cất, phát hiện thời điểm thích hợp để thu chất, đồng thời kiểm tra độ tinh khiết của chất thu được.
=> Chọn đáp án C.
Câu 26:
Tiến hành các thí nghiệm sau:
A. Thả viên Mg vào dung dịch HCl có nhỏ vài giọt dung dịch CuSO4.
B. Thả viên Fe vào dung dịch Fe2(SO4)3.
C. Thả viên Fe vào dung dịch Cu(NO3)2.
D. Thả viên Zn vào dung dịch H2SO4 loãng.
Số thí nghiệm xảy ra hiện tượng ăn mòn điện hóa là
 Xem đáp án
Xem đáp án
Điều kiện xảy ra ăn mòn điện hóa:
+ 2 điện cực khác nhau về bản chất (kim loại - kim loại, kim loại - phi kim, ...)
+ 2 điện cực tiếp xúc trực tiếp hoặc gián tiếp qua dây dẫn
+ 2 điện cực cùng tiếp xúc với dung dịch chất điện li
(1) Mg + CuSO4 MgSO4 + Cu : 2 điện cực Mg, Cu và Cu sinh ra bám lên thanh Mg (thỏa mãn) ăn mòn điện hóa
(2) Fe + Fe2 (SO4)3 2FeSO4: không có 2 điện cực
(3) Fe + Cu(NO3)2 Fe(NO3)2 + Cu : 2 điện cực Fe, Cu và Cu sinh ra bám lên thanh Fe(thỏa mãn) ăn mòn điện hóa
(4) Zn + HCl ZnCl2 + H2: không có 2 điện cực
Chọn đáp án D.
Câu 27:
Thực hiện các thí nghiệm sau:
a) Cho NaHCO3 vào dung dịch CH3COOH.
b) Cho phân đạm ure vào dung dịch Ba(OH)2 nóng.
c) Cho Fe2O3 vào dung dịch HNO3 đặc, nóng.
d) Cho P vào dung dịch H2SO4 đặc, nóng.
e) Cho Al4C3 vào nước.
Số thí nghiệm có khí thoát ra là:
 Xem đáp án
Xem đáp án
Các thí nghiệm có thoát khí là:
(a) thoát khí CO.
(b) thoát khí NH3.
(d) thoát khí SO2.
(e) thoát khí CH4.
=> Chọn đáp án B.
Câu 28:
Thực hiện các thí nghiệm sau:
(1) Sục etilen vào dung dịch KMnO4.
(2) Cho dung dịch natri stearat vào dung dịch Ca(OH)2.
(3) Sục etylamin vào dung dịch axit axetic.
(4) Cho fructozơ tác dụng với Cu(OH)2.
(5) Cho ancol etylic tác dụng với CuO đun nóng.
Sau khi các phản ứng xảy ra hoàn toàn, có bao nhiêu thí nghiệm không thu được chất rắn?
 Xem đáp án
Xem đáp án
Xét từng thí nghiệm:
(1) thu được rắn MnO2.
(2) thu được rắn là kết tủa canxit stearat.
(3) không thu được rắn vì muối tạo ra tan.
(4) không thu được rắn vì Cu(OH)2 bị hòa tan theo kiểu phức poliol.
(5) thu được rắn là Cu.
=> Chọn đáp án A.
Câu 30:
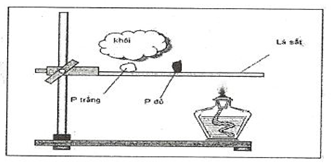
Hình vẽ dưới đây mô tả thí nghiệm chứng minh:
 Xem đáp án
Xem đáp án
của P đỏ dễ hơn P trắn
Nhận thấy thí nghiệm trên, P đỏ để gần đèn cồn hơn P trắng. Tuy nhiên P đỏ không bốc cháy, P trắng bị bốc cháy.
Nhiệt độ tại P đỏ cao hơn nhiệt độ tại P trắng.
P đỏ bền hơn, P trắng kém bền hơn hay khả năng bốc cháy của P trắng dễ hơn P đỏ.
Chọn đáp án A
Câu 31:
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư; (b) Sục khí Cl2 vào dung dịch FeCl2;
(c) Dẫn khí H2 dư qua bột CuO nung nóng; (d) Cho Na vào dung dịch CuSO4 dư;
(e) Nhiệt phân AgNO3; (g) Đốt FeS2 trong không khí;
(h) Điện phân dung dịch CuSO4 với điện cực trơ;
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là:
 Xem đáp án
Xem đáp án
Xét từng thí nghiệm:
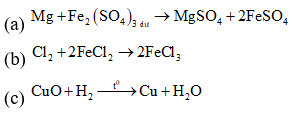
![]()
![]()
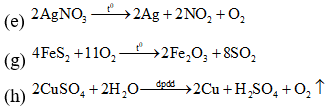
Sau khi kết thúc các phản ứng, thí nghiệm thu được kim loại: (c), (e), (h).
→ Số thí nghiệm thu được kim loại là 3.
→ Chọn đáp án A.
Câu 32:
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với các thuốc thử được ghi ở bảng sau:
|
Chất |
Thuốc thử |
Hiện tượng |
|
X |
Cu(OH)2 trong môi trường kiềm |
Có màu tím |
|
Y |
Đun nóng vói dung dịch NaOH dư, sau đó làm nguội, cho tiếp vài giọt dung dịch CuSO4 |
Xuất hiện màu xanh lam |
|
Z |
Nước Br2 |
Kết tủa trắng |
|
T |
Dung dịch AgNO3 trong NH3, đun nóng |
Kết tủa Ag trắng sáng |
Dung dịch X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Chọn A

